
BRAU- und MESSTECHNIK
Brausystem, eingesetzte Messverfahren und weitere Techniken im Überblick
BRAU- und MESSTECHNIK
Brausystem, eingesetzte Messverfahren und weitere Techniken im Überblick
ENZYME machen BIER
MALZENZYME - entscheidend für Maischevorgänge --> WÜRZE
HEFEENZYME - vergären Zuckerarten der Würze zu --> CO2 und Ethanol

Inhaltsverzeichnis PDF

Quelle: Roche Biochemical Pathways, Part 1



Stand 18.08.2024
Enzyme: Aufbau und Beeinflussungsmöglichkeiten
Enzyme: sind die Stoffwechselrealisatoren - beim Mälzen bereit gestellt, beim Maischen aktiviert (–> vergärbare Zucker) und im Gärprozess führen sie komplexe Stoffumwandlungen durch (–> Alkohol, CO2 und Aromen). Enzyme sind, neben den Hefen, die von den Brauern am wenigsten bekannte und in ihrer Auswirkung gewürdigte Komponenten des gesamten Bierherstellungsprozesses! Und: Hefen enthalten nicht alle zum gesamten Brauprozess notwendigen Enzyme.
ENZYME: BAU, FUNKTIONEN und ANWENDUNGSWISSEN
1. Kurzeinführung - Bau und Funktion der Enzyme
2. Enzyme - durch welche Faktoren können sie in ihrer Wirkung - auch brautechnisch - beeinflusst werden?
2.1. Abhängigkeit von der Temperatur
2.2. Abhängigkeit vom pH-Wert
2.3. Abhängigkeit von der Substratkonzentration
2.4. Abhängigkeit von Cosubstraten und Cofaktoren
2.5. Abhängigkeit von Hemmstoffen
3. Enzyme - Überblick (fast aller) am Mälzen, Brauen und Gären beteiligten Enzyme
3.1. Mälzvorgang: Bereitstellung wichtiger Brauenzyme (= "endogene" Enzyme)
3.2. Brauvorgang: Maischen - enzymatische Bierwürzebildung liefert Substrate für den Gärstoffwechsel
3.2.1. Abbau der Zellwandkomponenten
3.2.2. Endogene enzymatische Verzuckerung der Stärke als Grundlage für den nachfolgenden Gärstoffwechsel
3.3. Gärungsstoffwechsel: Enzyme gewisser Mikroorganismen (Hefe, Milchsäurebakterien) “brauen” Bier
4. Spezialaspekte
4.1. Enzyme der Aromabildung
4.2. Grünmalz
4.3. Industriell im Brauprozess eingesetzte Enzyme (= "exogene" Enzyme)
5. Quintessenz: “Enzymwissen für Brauer” oder “Enzyme für Spitzenbiere optimieren"
6. Anhang: Die wichtigsten Substrate der endogenen Brauenzyme (Gerstenmalzenzyme) und der Hefen-Gärenzyme
6.1. Monosaccharide: GLUCOSE (Traubenzucker, syn. Dextrose, Brauzucker), FRUCTOSE (Fruchtzucker), MANNOSE und GALACTOSE (Schleimzucker)
6.2. Disaccharide: MALTOSE (Malzzucker), SACCHAROSE (Haushaltszucker, Rohrzucker), LACTOSE (Milchzucker) und MELIBIOSE
6.3. Trisaccharide: MALTOTRIOSE und RAFFINOSE
6.4. Polysaccharide: DEXTRIN und MALTODEXTRIN, STÄRKE, CELLULOSE und NICHTSTÄRKEARTIGE POLYSACCHARIDE
6.5. Stärkeabbau durch endogene amolytische Enzyme (Verzuckerung)
6.6. Stärke- und Zellwand-abbauende hydrolytische Enzyme - stark vereinfachte Darstellungen
Literatur/ Quellen
1. Kurzeinführung - Bau und Funktion der Enzyme
Lebewesen sind grundsätzlich aus kleinsten Einheiten, meist Zellen aufgebaut, so auch die einzelligen Hefen. Zellen als kleinste lebende Einheiten zeigen ein zentrales Merkmal, nämlich den Stoffwechsel (auch Metabolismus): darunter versteht man die Gesamtheit aller biochemischen Reaktionen, die letztlich für den aufbauenden Baustoffwechsel und den abbauenden Energiestoffwechsel verantwortlich sind. Der Baustoffwechsel stellt z.B. die Bausteine der Zellwände (wie Lipide [Fette] oder Proteine [Eiweisse]), der Zellorganellen wie Mitochondrien (Atmungsorganell) oder Transportmoleküle wie Glucose- und Maltosetransporter (Lit.) her. Dies verleiht dem Organismus eine gewisse zeitliche Stabilität und ermöglicht Wachstum und Vermehrung. Dies ist aber nur möglich bei dauernder und schneller Energiebereitstellung. Der Energiestoffwechsel gewinnt aus dem Abbau der aufgenommenen Nahrungsmittelmoleküle wie Stärke, Zuckereinheiten oder Fette ständig zur Aufrechterhaltung aller biochemischen Reaktionen notwendige Energie her, meist in Form der wichtigsten universellen biologischen Grundwährungseinheit ATP (Adenosintriphosphat) her. Auch der stoffliche Informationsträger, die Erbsubstanz DNA (Desoxyribonucleinsäure, acid engl. für Säure) wird unter Energieaufwand aus materiellen Bausteinen, den 4 “Lebensbuchstaben” in Form chemischer Basen (A [Adenin], T [Thymin], G [Guanin], C [Cytosin]) synthetisiert. Leben ist also letztlich ein “Wechselspiel” zwischen Materie (stoffliche Bausteine), Energie (ATP) und Information (DNA).
Alle tierischen Zellen wie auch die Hefezellen verwerten zur Energiegewinnung vor allem das energiereiche Glucosemolekül. Die zur Energiegewinnung notwendigen abbauenden Reaktionen laufen allerdings nicht spontan ab, Glucose wie viele anderen biologischen Moleküle ist ausgesprochen reaktionsträge. Diese Reaktionsträgheit ist paradoxerweise eine der fundamentalen Voraussetzungen des Lebens, denn wenn energiereiche Moleküle ständig ungehindert miteinander reagieren würden, ergäbe das ein chemisches Chaos und keine Zellstruktur wäre stabil. Aber umgekehrt könnten sehr reaktionsträge Moleküle auch keine der zahllosen komplizierten Reaktionen ermöglichen, die insgesamt den lebenserhaltenden Stoffwechsel bilden. Und diese Stoffwechselreaktionen müssen im Vergleich zur Lebensdauer einer Zelle bzw. eines Organismus ungeheuer schnell ablaufen.
Chemische bzw. biochemische bzw. molekularbiologische Reaktionen können nur ablaufen, wenn mindestens zwei prinzipielle Erfordernisse zur Überwindung der Reaktionsträgheit erfüllt sind:
1. Zusammenstösse bei geeigneter Temperatur:
Eine chemische Reaktion erfolgt immer durch das Zusammenstossen von Teilchen wie Molekülen, die sich aber in einer günstigen räumlichen Lage aufeinander treffen müssen = effektiver Zusammenstoss. Bei höheren Temperaturen laufen chemische Reaktionen rascher ab, da die Zusammenstosswahrscheinlichkeit zunimmt und auch die verfügbare chemische Reaktionsenergie. Es gilt die sog. RGT-Faustregel (RGT: Reaktions-Geschwindigkeit Temperatur): Eine Erhöhung um 10 °C verdoppelt die Reaktionsgeschwindigkeit. Zellen allerdings bestehen aus delikaten Proteinen, die sehr temperatursensitiv sind und ab einer bestimmten Temperatur ihre Funktionsfähigkeit verlieren. Als Temperaturoptimum wird die Temperatur bezeichnet, die für ein Lebewesen oder ein Enzym die optimale Lebens- bzw. Reaktionsbedingung darstellt. Enzyme im menschlichen Organismus haben typischerweise ein Temperaturoptimum um 37°C und sind damit der Körpertemperatur angepasst. Bei anderen Organismen fällt das Temperaturoptimum der Enzyme je nach Lebensraum und den dort herrschenden Bedingungen höher oder niedriger aus. Bei den wichtigsten Bierhefen liegen die ideale Temperatur bei den obergärigen Sorten (Saccharomyces cerevisiae) zwischen 18-22 °C, bei den untergärigen Lagerhefestämmen (Saccharomyces pastorianus) liegt sie zwischen 7-15°C (cf. Abb. 1 [Lit.]).

2. Aktivierungsenergie:Energiereiche Moleküle wie Zuckerarten (Bsp. Glukose, Maltose, Polyzucker wie Stärke) wären gefährlich und nicht lagerfähig, wenn sie bei der leichtesten Bewegung/Erschütterung/Zusammenstoss plötzlich die gesamte chemische Energie freisetzen würden (Glucose: Δ = - 2822kJ/mol; Maltose: Δ = - 5610kJ/mol). Die Energiemenge, die zur Auslösung einer Reaktion aufgewendet werden muss, wird als Aktivierungsenergie bezeichnet. Diese stellt eine Art Energieschwelle dar, die überwunden werden muss, um reaktionsträge Stoffe zur Reaktion zu bringen. Dieser zu überwindende “Energieberg” ist die Ursache der Reaktionsträgheit. Grafisch veranschaulicht zeigt die Abb. 2 in violetter Farbe den Reaktionsverlauf der Spaltreaktion von gewöhnlichem Haushaltszucker Saccharose C12H22O11 + H2O –> Glucose C6H12O6 + Fructose C6H12O6 (cf. Strukturformeln). Rot zeigt die mit erheblich geringerem Energieaufwand dank einem Biokatalysator bzw. Enzym Saccharase ablaufende Zuckerspaltreaktion Doppelzucker in zwei Einfach-zucker. Dank diesem viel geringeren Energieaufwand laufen überhaupt biochemische Reaktionen in Zellen bei den doch relativ tiefen physiologischen Temperaturen ab und vor allem viel rascher als unkatalysiert.
Enzyme sind also Schlüsselsubstanzen zu allen Stoffwechselvorgängen und damit zum Leben allgemein.
Was sind nun Enzyme und wie funktionieren sie überhaupt?
Wie erwähnt, sind in einer lebenden Zelle die Überwindung der Reaktionsträgheit der Biomoleküle nicht durch beliebige Wärmezufuhr möglich. Beim Menschen herrscht eine konstante Binnentemperatur von 37 °C, bei Hefen sind Temperaturen zwischen etwa 5 bis 40 °C möglich. Daher musste die Natur einen genialen Trick erfinden, nämlich eine Reaktionsbeschleunigung ohne massive Energiezufuhr, etwas was der Chemiker als Katalysator bezeichnet: “Als Katalysator (von der Katalyse, griechisch , katálysis - Auflösung mit lateinischer Endung) bezeichnet man in der Chemie einen Stoff, der die Reaktionsgeschwindigkeit einer chemischen Reaktion beeinflusst, ohne dabei selbst verbraucht zu werden. Dies geschieht i.d.R. durch Herabsetzung der Aktivierungsenergie. Katalysatoren, die die Aktivierungsenergie herabsetzen, werden als positive Katalysatoren bezeichnet.” (Lit.). Katalysatoren sind häufig anorganischer Natur. Biokatalysatoren in der Zelle sind von organischer Natur. “Biokatalysatoren sind polymere Biomoleküle, die biochemische Reaktionen in Organismen beschleunigen oder verlangsamen, indem sie die Aktivierungsenergie der Reaktionen herab- oder (seltener) heraufsetzen. Sie gehen selbst unverändert aus den Reaktionen hervor und können somit viele Reaktionszyklen hintereinander katalysieren” (Lit.).
Enzyme, früher Fermente genannt, sind meist Proteine einer ganz bestimmten Bauart: sie sind stofflich betrachtet wie alle anderen Proteine nichts anderes als Kettenmoleküle aus 20 Standardaminosäuren, die zu jeweils charakteristischen und einzigartigen Raumstrukturen (= Konformation) gefaltet sind. Die Anzahl der verschiedenen Aminosäuretypen und die Anzahl Aminosäuren ingesamt in einer Kette ermöglichen eine praktisch unbegrenzte Anzahl verschiedenster Proteinstrukturen und damit verschiedenster Funktionen (Bauproteine z.B. für Zellmembranen und Funktionsproteine wie Enzyme, Hormone, Transportproteine u.v.m. [Info1, Info2).
Der Aufbau bzw. die Raumstruktur von Enzymen zeigt nun allerdings eine Besonderheit, die für ihre katalytischen Wirksamkeit von entscheidender Bedeutung ist: Abschnitte der Aminosäurekette bilden eine muldenartige Vertiefung, in welche die Substanz, die reagieren z.B. umgewandelt oder gespalten werden soll, hineinpasst wie ein Schlüssel in sein Schloss (“Schlüssel-Schloss-Prinzip”). Die einzig form- und bindungsgerechte passende Substanz wird als Substrat bezeichnet, die muldenartige Vertiefung als aktives Zentrum.(= Bindungszentrum).
An dieser Stelle sitzt das eigentliche katalytische Zentrum, an der das viel grössere Enzym seine Wirkung, z.B. eine Spaltung entfalten kann (Abb. 3). Der E-S-Reaktionszyklus läuft extrem rasch ab, das Enzym kann immer wieder eingesetzt werden. Eine gute und einfache Zusammenfassung von Proteinen und Enzyme findet sich hier.
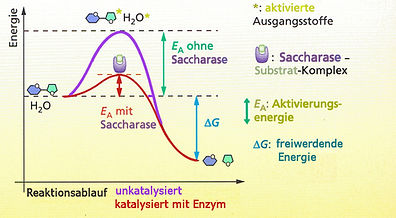
Abb. 2. Energetischer Verlauf von nicht-katalysierter und enzymatisch katalysierter biochemischer Reaktion.
Dargestellt ist die enzymatische Spaltung des Haushaltzuckers (Saccharose, Doppelzucker aus Glucose [Traubenzucker] und Fructose [Fruchtzucker]) durch das Enzym Saccharase im Vergleich zur nichtkatalysierten Zuckerspaltung:
C12H22O11 + H2O + ENZYM Saccharase --> C6H12O6 + C6H12O6 + ΔG.
Ohne Enzym muss zur Spaltung zusätzliche Energie aufgewendet werden, die sog. Aktivierungsenergie EA, welche die Ausgangsstoffe aktiviert, damit unstabiler macht und die Spaltung in die beiden Einfachzucker Glucose und Fructose ermöglicht.
Bei der Enzymreaktion wird das Substrat Zucker vom Enzym erkannt und gebunden --> Enzym-Substrat-Komplex. Es wird deutlich weniger Energie zur Aktivierung benötigt, sodass der gesamte Reaktionsverlauf sogar einen Energiegewinn ΔG von -29 kJ/mol liefert. [Quelle: Probst, 2007, mod.]

Abb. 3. Maltase Enzymwirkung.
Alle enzymatisch katalysierten Reaktionen laufen nach einem einheitlichen Schema ab:
1. Phase: Anlagerung des Substrats an das aktive Zentrum –> Enzym-Substrat-Verbindung (ES).
2. Phase: aktivierter Übergangszustand mit maximaler Reaktionsbereitschaft (“Verbiegung der chemischen Bindung = Lockerung”).
3. Reaktion am Substrat, z.B. Spaltung.
4. Phase: Freisetzung der freien Reaktionsprodukte –> unverändertes Enzym ist wieder einsatzbereit.
Ein "falsches" Zuckersubstrat wie z.B. der Doppelzucker Saccharose passt nicht in das aktive Zentrum und wird nicht umgesetzt. Nur einzig und al,leine Maltose passt wie ein Schlüssel in die räumliche Struktur des aktiven Zentrums = substratspezifisch. [Quelle, mod.]
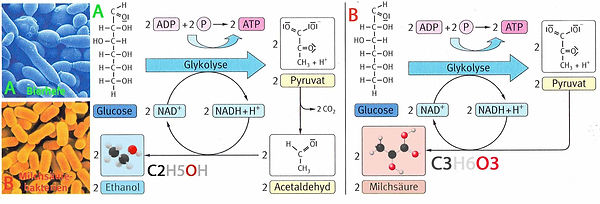
Enzyme sind aber nicht nur substratspezifisch, d.h. erkennen aus Millionen von möglichen Substraten nur ein einzig passendes Substrat, sie sind auch reaktionsspezifisch, d.h. sie katalysieren von verschieden möglichen Reaktionen nur eine ganz bestimmte, z.B. in Richtung Ethanolgärung oder Milchsäuregärung. Beide je spezifischen Enzyme “erkennen” ihr identisches Substrat (= die C3-Verbindung Pyruvat C3H3O-, aber sie katalysieren eine andere chemische Umsetzung. Bei der alkoholischen Gärung wird aus der C3-Verbindung ein C als CO2 abgespalten und damit das C2-Zwischenprodukt Acetaldehyd CH3-CHO zum H-reicheren C2-Endprodukt Ethanol C2H6O = C2H5OH gebildet (Abb. 4). Bei der anderen Gärungsform wird C3-Pyruvat C3H3O- mit 3 gebundenen H-Atomen zur Milchsäure C3H5O3– mit 5 H-Atomen reduziert. Bei beiden Reaktionen wirkt die Substanz NAD+ als H-Überträger, bei der Alkoholgärung als H-Spender (= reduzierend), bei der Milchsäuregärung als H-Empfänger (= oxidierend).
Abb. 4. Enzyme wirken reaktionsspezifisch.
Schematische Darstellung der Wirkungsspezifität von Enzymen am Beispiel der Alkoholgärung (links) und
der Milchsäuregärung (rechts). [Quelle: unbekannt, mod.]
2. Enzyme - durch welche Faktoren können sie in ihrer Wirkung - auch brautechnisch - beeinflusst werden?
Die Aktivität eines Enzyms zeigt sich in der von ihm in einer bestimmten Zeit umgesetzten Substratmenge, d.h. der Stoffumsatz pro Zeit ist als Reaktionsgeschwindigkeit definiert, was wiederum ein praktisches Mass für die Enzymaktivität ist. Bei einer bestimmten Enzymkonzentration hängt die Reaktionsgeschwindigkeit von verschieden Faktoren ab:
-
1 Temperatur: beschleunigt chemisch-biochemische Reaktionen, verändert und zerstört ab einer bestimmten Temperatur Eiweissstrukturen.
-
2 pH-Wert: jedes Enzym ist nur innerhalb eines bestimmten pH-Bereichs wirksam, bei einem pH-Optimum maximal.
-
3 Substratkonzentration: zunehmende Substratkonzentration kann bis zu einer Enzymsättigung die Reaktionsgeschwindigkeit und damit den Umsatz/Produktbildung beschleunigen.
-
4 Cosubstrate (= Coenzyme) und Cofaktoren: Coenzyme, besser Cosubstrate und Cofaktoren als Reaktionspartner von Enzymen sind niedrigmolekulare,
nichtproteinartige Bestandteile von Enzymen. Cosubstrate (latein. cum = zusammen, mit) sind komplexe organische Moleküle (Vitamine, Nucleotide), die meist nur locker oder vorübergehend, seltener fest an den Proteinanteil des Enzyms gebunden sind. Cofaktor ist ein Überbegriff: er umfasst anorganische Komponenten wie Metall-Ionen und Coenzyme. Mit enzymatisch wichtige Metall-Ionen wirken zum Beispiel Zink-, Eisen- und Kupfer-Ionen. -
5 Hemmstoffe (Inhibitoren): blockieren je nach Substanzklasse die Enzymwirkung.
2.1. Abhängigkeit von der Temperatur –> siehe ausführlichere Behandlung der Temperatur auf alle Brauprozesse auf dieser Website hier
Genauere Betrachtung der Abhängigkeit der Enzymaktivitäten mit brautechnischem Schwerpunkt
Die beiden wichtigsten Faktoren, mit denen die Aktivitäten der “Brau- und Gärenzyme” gesteuert werden kann, sind Temperatur und pH-Wert. Jede chemische bzw. biochemische Reaktion wird durch Temperaturerhöhung beschleunigt. Diese RGT-Regel (Reaktions-Geschwindigkeits-Temperatur) gilt auch für enzymatisch katalysierte Reaktionen, allerdings mit Einschränkungen, denn Enzyme sind delikate temperatur-sensitive Eiweissstrukturen (Abb. 5).

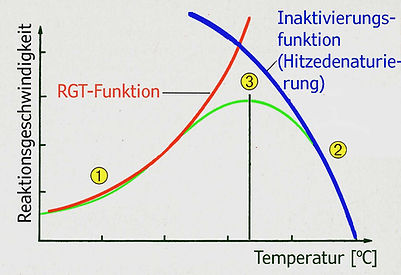
Abb. 5. Temperaturabhängigkeit der Enzymaktivität.
Die Temperaturabhängigkeit der enzymatischen Aktivität ist in der Regel unsymmetrisch. Die Enzymaktivität ist eine Resultierende aus zwei gegenläufigen Funktionen: 1. der RGT-Funktion und 2. der Denaturierung bzw. Strukturveränderung bis Strukturzerstörung mit zunehmender Temperatur über das Temperaturoptimum hinaus und der parallel dazu einher gehenden Funktionseinschränkung bis Funktionsverlust (= Inaktivierung).
➀ Mit zunehmender Temperatur erhöht sich die Reaktionsgeschwindigkeit, weil durch Beschleunigung der Moleküle die Trefferwahrscheinlichkeit eines Zusammenstosses erhöht wird und deshalb mehr Enzym-Substrat-Komplexe ES gebildet werden (= RGT-Regel).
➁ Ab einer bestimmten Temperatur oberhalb des Temperaturoptimums lässt die katalytische Wirksamkeit des Enzyms erheblich nach, weil Proteine durch die Hitze denaturiert werden, d.h. ihre Raumstruktur wird verändert bis zerstört.
➂ Aus der Überlagerung dieser beiden Effekte ergibt sich ein Temperaturoptimum, das für die Enzyme jedes Organismus bei einem charakteristischen Wert liegt.
In der umfangreichen Tabelle Abb. 6 sind die Temperaturwerte für den aktiven Temperaturbereich und das Temperaturoptimum der wichtigsten Enzyme während des Maischeprozesses festgehalten. Die Angaben schwanken leicht je nach Quelle. Die Bestimmung der optimalen Temperatur erfolgt meist an einzelnen gereinigten Enzymen im Reagenzglas: die so erhaltenen Werte können abweichen von z.B. den in einer Maische gewonnenen Werten, da verschiedene Faktoren zusätzlich einwirken wie z.B. Ionenkonzentrationen, Maischedicke, Ziel des Maischevorganges (Bierstil, Biercharakteristik, [z.B. trockenes, schlankes Bier; süsses vollmundiges Bier; kerniges, schlankes Bier; kerniges, vollmundiges Bier; kerniges alkoholreiches Bier; helles, hochvergärendes Bier]), Maischedauer, Maischeverfahren (Dekoktion, Infusion [= Aufheizverfahren als Kesselmaische in einem Gefäss], Einmaischverfahren, Zweimaischverfahren, Dreimaischverfahren) Biermundigkeit, Stammwürze, Malzkörper, Aromen). Hier kommen nun die verschiedenen bestimmten Temperaturstufen, Rasten genannt, ins Spiel. Rasten sind bestimmte Temperaturfenster, in denen die Enzyme voll aktiv sind, also alles andere als “rasten”! Diese Rasten als Prozessschritte sollen bestimmten Enzymen je nach Bierstil ideale Temperatur- und Zeitbedingungen bieten, letztlich durch Verstärkung oder Abschwächung bestimmter Enzymaktivitäten. Der Prozess des Maischens besteht also darin, dass die Maische, also das Malzschrot-Wasser-Gemisch stufenweise auf die jeweiligen Optimaltemperaturen der notwendigen rasttypischen Enzyme erwärmt wird und dort jeweils die Temperatur eine bestimmte Zeit lang konstant hält, um genügend der erwünschten Umsetzungsprodukte wie z.B. Maltose, Glucose, andere Zuckerarten, Aromastoffe oder Hefenährstoffe zu produzieren. Zum Überblick sind die verschiedenen Rasten unter Abb. 14 zusammen getragen (cf. auch "3.2. Brauvorgang: Maischen - enzymatische Würzegewinnung ..." aus verschiedenen Quellen als Tabelle in Abb. 13 (Brücklmeier 1: 124, Kraftbier, u.a.).
Abb. 6.
Die wichtigsten
“endogenen Brauenzyme"
aus der Sicht des Brauers.
Zusätzliche Informationen zur Wirkungsweise wichtiger Maischeenzyme siehe Abb. 11 sowie im Anhang Abb. 39 + 40
Enzyme, griech.
“In der Hefe”
Quellen:
1: Palmer
2: Brücklmeier
3: Sheppard
4: Farber/Bath
5: Narziss/Back
6: Narziss et al.
7: Basarova et al.
8: Brücklmeier
9: Kunze
10: Brücklmeier
(S. 147-148; Info)
Definitionen:
Monosaccharide:
Einfachzucker (Bsp. Glucose, Fructose)
Disaccharide:
Zweifachzucker
(Bsp. Haushaltzucker [Saccharose aus Glucose und Fructose])
Oligosaccharide:
aus 3 (Maltotriose) bis 20 Einfachzucker
Dextrine:
syn. Stärkegummi, Maltodextrine sind homologe Stärkeabbau-produkte, deren Molekülgrösse zwischen Oligosacchariden und Stärke liegen.
Polysaccharide:
grosse langkettige Kohlenhydrate aus über 20 bis Hunderte oder Tausende von Einfachzuckern (Bsp. Stärke, Cellulose).
Links:
Abb. 6. Die wichtigsten “Brauenzyme" aus der Sicht des Brauers. [Quellen: cf. Tabelle oben rechts]

WICHTIGES BRAUWISSEN:
Die Temperatur, kombiniert mit dem Zeitfaktor ist ein Schlüsselparameter zur Enzymbeeinflussung bzw. Enzymfunktionsoptimierung und damit für gelingende Maische- und Gärprozesse. Die Beachtung und Steuerung bzw. Regelung der Temperatur bei Brauprozessen ist von grösster Bedeutung!
Ausführliche Informationen zur Temperatur auf dieser Website hier !! insbes. zu Gärverläufen hier

2.2. Abhängigkeit vom pH-Wert –> siehe ausführlichere Behandlung des pH-Wertes auf alle Brauprozesse auf dieser Website hier
Enzymatische Reaktionen laufen wie alle zellulären Stoffwechselprozesse in einer wässrigen Umgebung ab. Die in ihr vorhandenen Mengen an Ionen, insbesondere die Menge an Wasserstoff-Ionen H+ (genauer H3O+), in der Chemie als pH-Wert ("Säuregrad") bezeichnet, hat den massgeblichsten Einfluss auf die Enzymaktivität. Dies liegt an ihren Protein-Eigenschaften. Einige Aminosäuren (AS) in der AS-Kette besitzen sauer bzw. auch basisch wirkende Reste (Seitenketten), die auf den pH-Wert der umgebenden Flüssigkeit reagieren. Da die Ionenbindungen zwischen den sauren und basischen Aminosäuren (Bsp. saure AS: Asparaginsäure, Asparagin, Glutaminsäure, Glutamin; basische AS: Lysin, Arginin, Histidin [Info]) zur Ausbildung der spezifischen Raumstruktur des Enzymmoleküls beitragen, wird eine Änderung des pH-Wertes zwangsläufig auch eine Veränderung dieser Raumstruktur mit sich bringen. Eine in-vitro-Messreihe des Einflusses des pH-Wertes auf die Enzymaktivität einer stärkespaltenden Amylase zeigt die typische Optimums-Kurve mit drei Sachverhalten:
-
1. Nur bei einem ganz bestimmten pH-Wert passt das aktive Zentrum optimal zu seinem Substrat: bei diesem Wert hat das Enzym sein pH-Optimum.
-
2. Sowohl ein höherer wie auch ein niedrigerer pH-Wert verschlechtert die Anlagerung des Substrats und die Reaktionsgeschwindigkeit lässt dadurch nach.
-
3. Extreme pH-Werte verändern offenbar die Enzymstruktur bis zur Inaktivierung des Enzyms
-

Der Einfluss des pH-Wertes auf alle Phasen der Biergewinnung (Maische, Gärung, Reifung/ Lagerung) ist ausführlich unter “Brau- und Gärparameter > 2. Der pH-Wert im Brauprozess, bei Gärungen und im Bier” behandelt (hier). Bei jedem pH-Wert sind alle Enzyme jeweils betroffen, es gibt keinen optimalen universalen pH-Wert für alle Brauprozesse. Aber genauso wie man für die Maischetemperatur einen optimalen Kompromisstemperaturwert finden kann (sog. Kombirast bzw. Diastaserast, cf. Brau- und Gärparameter > Abb. 19 hier), kann für die Maische ein pH-Wert zwischen 5.2-5.4 empfohlen werden (siehe diese Website Abb. 21 und Abb. 25).
Abb. 7. Stärke-abbauende Amylasenaktivitäten sind stark pH-abhängig.
pH-Optimum bei dieser Untersuchung zwischen 5.5 - 6.5
Die pH-Abhängigkeit der meisten enzymatischen Aktivitäten ist in der Regel symmetrisch. [Quelle, mod.]

WICHTIGES BRAUWISSEN:
Die Kontrolle und Regelung des pH-Wertes beim Maischen ist der zweite entscheidenste Schlüsselfaktor zum erfolgreichen Brauen und Erzielung von gutem Bier! Eine rasche und genaue pH-Bestimmung bei 25 Grad Celsius ist wichtig (korrekte Technik hier).
Ausführliche Informationen zum pH-Wert auf dieser Website hier !!
2.3. Abhängigkeit von der Subtratkonzentration
Die klassische Beschreibung einer einzelnen enzymatischen Substrat-Umsetzungsreaktion ist die einer Sättigungskurve (Abb. 8). Zunächst steigt die Reaktionsgeschwindigkeit beträchtlich an, weil mit der Konzentrationszunahme des Substrats die Trefferwahrscheinlichkeit grösser wird und immer mehr Substrat-Enzym-Komplexe gebildet werden (➀). Bald tritt aber bei höheren Substratkonzentrationen eine Sättigung ein, weil die Zahl der freien Enzymmoleküle und damit der aktiven Zentren abgenommen hat (➁). Ab einer bestimmten Substratkonzentration sind alle Enzymmoleküle mit Substratmolekülen abgesättigt, eine Steigerung der Reaktionsgeschwindigkeit ist nicht mehr möglich (➂).
Beim Maischen dürfte je nach Zeitvorgabe für die einzelnen Rastphasen, bedingt durch die grosse Menge an Stärke im zugeführten Malz, die Enzyme mit ausreichenden sättigenden Mengen an ihrem Substrat versorgt sein und keine Steigerung der Gesamtreaktionsgeschwindigkeit möglich sein. Die einzig denkbare Ausnahme wäre die Zufuhr von Maischeenzymen, primär diastatischen Charakters (also primär Amylasen).

Abb. 8. Abhängigkeit der Enzymaktivität von der Substratkonzentration.
Dieser Kurvenverlauf für die Reaktionsgeschwindigkeit ist strikte nur für ein einzelnes Enzym korrekt. Bei den Maischevorgängen, grob vereinfacht der Zuckerfreisetzung aus Stärkemolekülen, sind natürlich mehrere Enzyme verantwortlich. Bei einer enzymatischen Mehrstufenreaktion (z.B. Stärke-zerlegung während der Maische) und ganzen Reaktionsketten (z.B. alkoholische Gärung), also sog. Mehrsubstratreaktionen ist das “langsamste” Enzym das Schlüsselenzym für die Gesamtreaktionsgeschwindigkeit. Es bestimmt die Gesamtumsatzrate der mehrstufigen Reaktionen.
WICHTIGES BRAUWISSEN:
Die Substratkonzentration wird indirekt festgelegt durch die Zusammensetzung und Menge der Malzmischung sowie der zugeführten Wassermenge (Hauptguss). Entscheidend sind wohl nur ausreichende erfahrensbasierte Rastzeiten, um die im Überfluss vorhandenen Substrate in die gewünschten Zuckerarten umzuwandeln.

2.4. Abhängigkeit von Cosubstraten und Cofaktoren
Um katalytisch wirken zu können, benötigen manche Enzyme Cofaktoren. Erst zusammen bilden das Enzym (ohne Cofaktor = inaktives Apoenzym) mit dem Cofaktor das aktive vollständige Enzym (mit Cofaktor = aktives Holoenzym). Bei Cofaktoren handelt es sich um anorganische Komponenten wie Metallionen wie K+, Na+, Mg2+, Cu2+ oder Fe2+ und um organische Komponenten wie Vitamine (z.B. Biotin [Vitamin B7], Pantothensäure [Vitamin B5], Thiamin [Vitamin B1], Nucleotide und Cosubstrate wie ATP, NAD+ und Coenzym A. Diese Stoffe sind in den Nährsalzen für Hefen (z.B. Hefenährsalz Nutrisal [Info]) und insbesondere Hefenährstoffen (Hefenahrung, yeast nutrients, z.B. Lallemand Servomyces Nährstoff für Bierhefe [Info], White Labs Yeast Nutrient [Info], Wyeast Beer Nutrient Blend [Info] enthalten.
Alle diese Zusatzstoffe enthalten
-
Vitamine: wichtig für allgemeine Enzymfunktionen und Hefewachstum (Bsp. Biotin: unterstützt Basisstoffwechselfunktionen wie Enzymstruktur, Aminosäurestoffwechsel, Fettsäurenbiosynthese, Energiestoffwechsel). Zugabe mittels Hefenahrungszusätze.
-
Mneralische Salze: Phosphate, Kalium, Calcium, Magnesium und besonders Zink sind entscheidend für eine erfolgreiche Gärung. Sie werden als Spurenelemente in geringer Konzentration für z.B. die Glykolyse (Zuckerabbaustoffwechsel) und die alkoholische Gärung benötigt. Zinkmangel verursachen Fermentations- und Hefeflockungsprobleme. Würzezinkkonzentrationen im Bereich von 0.15–0.3 mg Zn/L) unterstützen die Maltose- und Maltotrioseaufnahme, Proteinsynthesevorgänge und allgemein das Hefewachstum, schützt Enzyme und stabilisiert Protein- und Membransysteme, welche wiederum zu raschen Fermentationsvorgängen und besserer Ausflockung führt. Zink kann als Zinksulfat und in Zn-haltigen Hefenahrungsmischungen zugeführt werden.
-
Kohlenstoff, Sauerstoff, Stickstoff: Kohlenstoff als essenzielles Element der Kohlenhydrate wird nicht als Hefenährstoff zudosiert, da es in zahlreichen
organischen C-Verbindungen wie Zuckerarten aus dem Malz (Maltose, Maltotriose, sowie kleine Mengen an Saccharose (Haushaltzucker), Glukose und
Fruktose vorhanden ist. Die Gewinnung von Kohlenstoffverbindungen erfolgt über den Zuckerabbau in der Glykolyse [Info-Video].
Sauerstoff ist eine weitere wichtige Komponente im Hefestoffwechsel, die für eine effiziente Zellteilung unmittelbar nach der Hefeanstellung benötigt
wird, und zwar nicht für einen aeroben Energiestoffwechsel, sondern für die O2-abhängige Synthese der Sterole und ungesättigten Fettsäuren, die
wiederum entscheidend für den Unterhalt und die Neubildung der Zellmembranen bei der Zellteilung sind (siehe ausführliche Erläuterungen dazu hier).
Die Sterole und ungesättigten Fettsäuren sind stress-reduzierende Faktoren, sie halten die Membranen stabil und damit vitale Hefefunktionen und deren
Viabilität. Sauerstoffmangel bei der Hefeanstellung führt zu einer ungenügenden Fermentation und hohen Mengen an Acetyl-Coenzym A, was wiederum
zu hohen Gehalten an Estern führt mit entsprechenden geschmacklichen Auswirkungen. Beim Einsatz von Trockenhefen kann auf die Belüftung
verzichtet werden, da diese über ausreichende Sterolmengen verfügen.
Stickstoff ist in Proteinen, Peptiden (kleinere Eiweisse), Aminosäuren und Ammonium (NH4+-Salze, wie Ammoniumnitrat [NH4NO3], Ammoniumchlorid
[NH4Cl] oder Diammoniumhydrogenphosphat [(NH4)2HPO4] vorhanden. Der “freie Aminostickstoff” (free amino nitrogen, FAN) wird zu rund 70%
während des Maischens aus dem Malz herausgelöst und ist ein Summenparameter für die verfügbaren Aminosäuren und kleinen Peptide in der Würze.
Wenn keine Malzzusätze diese FAN-Menge verdünnen, sollte die N-Versorgung ausreichend sein, sonst kann sie aber durch Hefeextrakte oder
inaktivierte Hefezellen oder anorganische NH4-Verbindungen auf 140 mg/L ergänzt werden.

WICHTIGES BRAUWISSEN:
Die Zugabe von Hefenährstoffen ist nicht zwingend, von Spezialbrauansätzen (z.B. Biere mit hoher Stammwürze, strikt reproduzierbare Gärverläufe) abgesehen, um erfolgreiche Gärungen zu erhalten. Solche Hefenahrungszusätze können aber eine Garantie oder “Versicherung” für reproduzierbare erfolgreiche Gärverläufe und damit deren Produkte sein.
2.5. Abhängigkeit von Hemmstoffen
Enzymhemmung ist die negative Beeinflussung einer enzymatischen Reaktion durch einen Hemmstoff, den sog. Inhibitor. Dabei wird die Geschwindigkeit der Reaktion herabgesetzt. Die Hemmstoffe können an unterschiedliche an der Reaktion beteiligten Stoffe binden, wie zum Beispiel an das Enzym oder das Substrat. Auch der Bindungsort am Enzym kann vom aktiven Zentrum, an dem das Substrat bindet, bis hin zu anderen Stellen, die für die Aktivität des Enzyms wichtig sind, variieren.
Solche Hemmungen können durch hohe Salzkonzentrationen, hohe Konzentrationen an Alkalisalzen sowie Schwermetallen liegen. Solche Effekte können sich höchstens beim Brauen mit Extremwasser (z.B. Lischana-Quelle, Scuol: 4582 mg Mineralien/L ohne Hydrogencarbonat 6340 mg/L, Restalkalität 95.2 mmol/l (= 267.1°dH, [Info]) oder falsch dosierten Salzmengen zu Osmosebrauwasser bzw. destiliiertem Wasser ergeben. Zum Vergleich übliche “extreme” Werte: Wiener 22.1 °dH, Stout 18.2 °dH. Empfehlungen zur Restalkalität (RA) für unterschiedliche Biertypen: helle Biere im Bereich von 0 °dH, für Export, Kölsch, Lager kleiner 5 °dH, für Pilsbiere teilweise bis –5 °dH, Weizenbier grösser 5 °dH, jedoch kleiner 10 °dH.
Schweflige Säure H2SO3 2-4%ig wird im Gärspund (z.B. Duplex Gärglocke [Info]) eingefüllt und verhindert mit seiner stark entkeimenden Eigenschaften eine mikrobielle Kontamination der Bierwürze während des gesamten Gärverlaufs. Schweflige Säuren sind enzymdeaktivierend; diese Hemmung kann durch Zerstörung der Sekundär- und Tertiärstruktur der Enzyme erfolgen. Allerdings gelangen auch bei unvorsichtigem Handling wohl nur wenig Schwefliger Säure in die vergärende Bierwürzelösung und wird ausreichend verdünnt, sodass kaum eine merkbare Hemmung der Gärprozesse erfolgen kann.
Ethanol C2H5OH: Obwohl Ethanol ein Endprodukt der anaeroben Fermentation von Zuckern durch Hefe ist, ist es für Wachstum und Gärungsaktivitäten der Hefezellen toxisch und löst Stressreaktionen wie die Expression von Hitzeschockproteinen und die Akkumulation von Trehalose aus. Die toxische Konzentration macht sich deutlich bemerkbar ab ca. 70 g Ethanol/L. Hefezellen können maximal einen Alkoholgehalt von etwa 12–15 % erzeugen; dann sterben sie an ihren eigenen Ausscheidungsprodukten ab. Wirkungsmechanismus: Aufgrund seiner Lipophilie löst sich Ethanol in den Membranen und bringt die Ordnung der dort befindlichen Moleküle durcheinander. Die Membranordnung ist jedoch für das Funktionieren der Zellen entscheidend. Auch wird die Regulation des Zellwachstums bei knospenden Hefen gestört (Info).
Hitze: Durch Hitzeeinwirkung verlieren Eiweissstoffe wie Enzyme teilweise ihre Struktur und werden denaturiert. Die Enzyme werden je nach Struktur in unterschiedlicher Stärke betroffen. Dieser Effekt wird beim Darren selektiv ausgenutzt und spielt auch bei den Rastphasen eine wichtige Rolle.
Beispiel Darren: Die α-Amylasen zeigen am Ende des Darrens etwa 15% mehr Aktivität als im Grünmalz, während die temperaturempfindlicheren β-Amylasen sowie die Grenzdextrinase um ca. 40% gegenüber der Grünmalzaktivität geschwächt werden. Die zunehmende Temperatur beim Sudablauf resultiert in einer Inaktivierung der Enzyme; in der Tabelle Abb. 6 ist diese Inaktivierungstemperatur aller beteiligten Enzyme festgehalten, so z.B. der α-Amylasen (79 °C) und der β-Amylasen (70.5 °C).
3. Enzyme - Überblick (fast aller) am Mälzen, Brauen und Gären beteiligten Enzyme
3.1. Mälzvorgang: Bereitstellung wichtiger Brauenzyme (= "endogene" Enzyme)
Mälzen ist ein kontrollierter Keimvorgang, bei dem aus Getreide Malz entsteht. Durch den Keimvorgang werden im Korn Enzyme aktiviert und neu gebildet, die später als amylolytische Enzyme für den Stärkeabbau, als proteolytische Enzyme für den Eiweissabbau, als cytolytische Enzyme für den Abbau von Gummistoffen, Hemicellulose u.a. und als säurebildenden Enzyme für den Phosphatabbau während des Bierbrauens notwendig sind.
Beim Weichen wird das Braugetreide während 1–2 Tagen befeuchtet, bis der Wassergehalt des Lagerkornes von etwa 12 % auf 35–43 % angehoben wird. Bereits bei einem Wassergehalt von rund 30 % ist eine deutliche Steigerung des Lebensprozesses im Korn zu verzeichnen, nämlich eine Aktivitätenzunahme von Enzymen wie Amylasen (–> Stärkezerlegung), Ribonucleasen (–> Ribonucleinsäuren –> genetische Information in Proteine) und Phosphatasen (–> Phosphate –> Energiestoffwechsel, ATP-Bildung). Die geweichte Gerstenkörner bzw. anderer Getreidekörner keimt nun während 4–7 Tagen bei einem Wassergehalt von ca. 43–48 %. Dabei bilden sich aus dem Keimling des Kornes Blatt- und Wurzelkeime und es werden im Korn Enzyme (“Diastase” = Stärkehydrolyse in Zucker durch Amylasen) gebildet bzw. aktiviert. Dieses Grünmalz würde nun weiter keimen und die gelagerten Reservestoffe, primär die Stärke in die typischen Pflanzenorgane Wurzel, Sprossachse und Blätter umwandeln. Damit wäre aber auch die Grundlage aller vergärbaren Zuckerarten verstoffwechselt und dies muss nun durch das sog. Darren gestoppt werden. Dies wird erreicht durch eine Trocknung des Grünmalzes bei 35 °C von einer Feuchte von 40–45 % auf 3–5 % zur Gewährleistung einer längeren Lagerfähigkeit und der Transportfähigkeit. Weiterhin werden beim Darren die malztypischen Farb- und Aromastoffe verstärkt. Beim Darrprozess wird das Grünmalz getrocknet in einem Keimlingsenzyme schonenden zweiphasigen Vorgang (Schwelken: relativ konstante Temperatur zur Verdunstung der Feuchtigkeit aus der Kornoberfläche; Darren: Temperaturanstieg je nach Malz- und späterer Bierfarbe (Darren bei über 70 °C: helles Malz bei 75–80 °C, dunkles Malz bei 105–120 °C, bei Farb- oder Röstmalz bei 180 bis 220 °C wirken die Temperaturen sogar enzymdenaturierend, um Malz- und Aromakomponenten zu verstärken).
Gibberelline: Das Gibberellin, das von Koleoptile (Blattkeimanlage oder Keimblattscheide) und Scutellum (Schildchen: "Saugorgan" zur Nährstoffversorgung des Embryos) produziert wird, gelangt in die Aleuronschicht (Kleberschicht) und bewirkt dort die Bildung von Glyoxisomen und die Synthese und Sekretion hydrolytischer Enzyme (u.a. α-Amylase), welche die Speichermakromoleküle des Endosperms (Mehlkörper/ Mehlkern der Getreidekörner) abbauen.
Zusatzinfo: Siehe auch Info über Mälzen und Malzübersicht. Eine genaue Beschreibung der Keimungsvorgänge mit den vielen involvierten Enzymen (zahlreiche β-Glucanasen [mind. 6 Typen], Pentosanasen [mind. 6 Typen], Endo-Peptidasen (“Proteinasen”), Exo-Peptidasen, Phosphatasen, Amylasen, Lipasen und zahlreichen weiteren Enzymen des pflanzlichen Grundstoffwechsels: cf. Narziss et al, Abriss der Bierbrauerei, 8. Aufl. (2017), Kap. 1.4 Keimung, S. 26-39.

In Abb. 9 wird die die Bildung der endogenen Enzyme im keimenden Gerstenkorn und deren Wirkungsorte in 3 Stufen dargestellt:
-
1. Aktivierung der Enzyme im Gerstenkorn: Bildung dreier Enzymgruppen im Endosperm mit den verschiedenen Wirkungsorten (Angriffsorte: 1. Proteine = Proteasen), 2. Cellulose = Cellulasen, 3. Stärke = Amylasen).
-
Proteasen: Abbau von Eiweissen im Zellcytoplasma und in Membranstrukturen: Die Protein-Grundbausteine, die Aminosäuren, werden für verschiedenste Stoffwechsel-Grundfunktionen und Strukturen benötigt. Bsp.: freie Aminosäuren (FAN), entscheidend für Hefen-Wachstum und deren Gesundheit (Vitabilität).
-
Cellulasen: Abbau der den Mehlkörper (Stärkekörner) umgebenden Zellwände. Wichtigste Enzyme: β-Glucanasen (für β-Glucane) und Pentosanasen (wie z.B. Xylanasen).
-
Amylasen: α- und β-Amylasen bauen den Vielfachzucker Stärke in kleinere Zuckereinheiten ab; diese Amlylasen sollen zwar während der Keimung gebildet, nicht aber in Funktion treten (die Stärke soll ja für die Gärung und nicht für die Keimpflanze umgesetzt werden!). Grenzdextrinasen und andere Stärkeverzweigungen-abbauende Enzyme werden ebenfalls in der Keimungsphase gebildet.
-
Während des Schwelkens (Wassergehaltssenkung [WGS] bei 40-50 °C, Malzfarbfestlegung) und Abdarren (definitive WGS bei ≥ 80 °C) werden Enzymaktivitäten z.T. durch Inaktivierung geschädigt (β-Amylasen > α-Amylasen).
-
2. Die Angriffsorte der Enzyme auf zellulärer Stufe im Zellinneren (= Cytoplasma mit Stärkekörnern und Proteinmatrix) und an den Zellwänden (innere und äussere Zellwand mit der Proteinlamelle).
-
3. Detailblick Zellwandstruktur: Die in den Zellwand-trennenden Proteinmittellamellen und den angrenzenden Zellwänden wirksamen Enzyme zur Solubilisierung und hydrolytischen Abbaus.
Abb. 9. Keimungsvorgänge: Bildung und Wirkung der endogenen Malzenzyme.
a: Enzymmobilisierung: 1. Der mit Wasser eingeweichte Embryo im Gerstenkorn nimmt zunächst Zuckermoleküle aus seiner unmittelbaren Umgebung auf. 2. Gibberelline (Hormone) werden vom sog. Schildchen (cf. Abb. 7 Gerstenkorn, in "Mug-Mikrobrauerei - Malz" hier) freigesetzt. 3. Gewisse bereits vorhandene Enzyme werden freigesetzt oder erst gebildet, um das Endosperm abzubauen.
b: Einwirkungsorte der freigesetzten bzw. gebildeten Enzyme auf die Endospermzellen.
c: Enzymatische Einwirkung an den Endosperm-Zellwänden:
Solubilisierungsenzyme: Xylanase, Acetylxylanesterase, Feruloylesterase, Arabinofuranosidase, Carboxypeptidase.
Hydrolytische Enzyme: Endo- und Exoglucanasen, Glucosidasen, Xylosidasen
(cf. auch Tab. 2/ S. 23 in Dickel, T., Untersuchungen zu enzymatischen Abbauprodukten beim Maischen 2003 (hier) [Quelle: Windhausen, mod.]

WICHTIGES BRAUWISSEN:
Das Mälzen ist selten Bestandteil des Hobbybrauer-Repertoires. Also verlassen wir uns auf die Qualität der gelieferten Malze, die heute bei allen Mälzereien sehr hoch ist. Bei der Lagerung im eigenen Keller sollten folgende Punkte beachtet werden, um maximale Enzymaktivitäten beim Maischen zu erhalten:
-
Lagerung: kühl, temperaturkonstant, luftdicht (!) und trocken (keine feuchte Luft aus Malz).
-
Lagerungsfähigkeit: Geschrotete Basismalz ist wasseranziehend und muss deshalb in gut verschliessbaren, luftdichten Behälter
gekühlt (oder tiefgefroren) aufbewahrt und möglichst innerhalb von 4 Wochen, spätestens aber nach 3 Monaten verbraut werden
(tiefgefroren deutlich länger lagerfähig). Karamellmalze (geschrotet): max. 6 Wochen, Farbmalze (Röstmalze, geschrotet): möglich
frisch. Ungeschrotet: max. 1 bis 2 Jahre; bei dunklem Malz bzw. Spezialmalzen max. 3 Monate.
-
Lagermöglichkeiten: offen auf Böden bzw. in Säcken schlecht (Feuchtigkeit, Schädlinge); in Malzkästen (Holz, Stahlblech) oder
Weithalstonnen/Weithalsfass. Optimal: Bester Aufbewahrungsort von Schrotmalz ist der Kühlschrank, ideal der Tiefkühlschrank.
Begründung: cf. Biologie der Gärung > 3.2. Sauerstoff und Braurohstoffe, Bier und Brauprozesse.
-
Malzkonditionierung (Wasserzugabe zu ungeschrotetem Malz unmittelbar vor dem Einmaischen): Zugabe von ca. 8 mL Wasser/1 kg Malz, gut einmischen, 1 Std. einwirken lassen, erst dann Schroten. Begründung: weichere Spelzen, bleiben eher unversehrt beim Schroten --> lockern Treber auf, erleichtern das Läutern und erhöhen Sudhausausbeute [Info, Variante Wassernebel]
-
siehe auch Info hier.
3.2. Brauvorgang: Maischen - enzymatische Bierwürzebildung liefert Substrate für den Gärstoffwechsel
3.2.1. Abbau der Zellwandkomponenten
Hefen können in ihrem Bau- und Energiestoffwechsel Einfachzucker wie Glucose (Glu), Fructose (Fru), und Galaktose nutzen oder aber Doppelzucker wie Maltose (= Glu-Glu) und Saccharose (Glu-Fru), indem sie diese enzymatisch in die Einfachzucker Glucose und Fructose umwandeln.
In Gerstenkörnern, allgemein Getreidekörnern sind die Kohlenhydrate primär als Stärke gespeichert. Beim Maischen müssen die Polysaccharide in fermentierbare Zucker umgewandelt werden. Nun sind aber die Kohlenhydratspeicher als Mehlkörper in den von Zellwänden umgebenen Zellen eingelagert und müssen aus diesem starren Gefängnis ebenfalls zunächst mechanisch und enzymatisch befreit werden. Dies geschieht vereinfacht dargestellt (cf. Abb. 10) enzymatisch durch Zellwandhydrolasen, mechanisch durch Quellung und Verkleisterung der Stärkekörner und nochmals enzymatisch durch Stärkehydrolasen, welche summarisch als cytolytische Enzyme bezeichnet werden können.
Abb. 10. Mobilisierung vergärbarer Zucker aus den Zellen des Gerstenkorn-Mehlkörpers.
Der Abbau der Hemicellulosen (wasserunlöslich) und Gummistoffe (β-Glucane, wasserlöslich), die sog. Cytolyse während des Mälzens (Abb. 9) wird bei den Maischevorgängen weitergeführt.
Brauwissen: Der wichtige Aspekt der enzymatischen Zellwandauflösung wird vom Brauer häufig zu wenig beachtet.
Wichtig: bei hohen Gummistoffanteilen (z.B. Wintergersten-malz, ungemälztes Getreide) sollte eine β-Glucanaserast (cf. Abb. 13) eingehalten werden.

Bildfolge: ❶ Gerstenähre --> ❷ Gerstenmalzkörner* --> ❸ Zellen des Endosperms (= Mehlkörper) mit Stärkekörnern (mikroskopisches Bild kombiniert mit Schemazeichnung) --> ❹ Einwirkung von Zellwand-Hydrolasen (Endosperm-Zellwände aus Hemicellulosen [ca. 75% Nichtstärkeartiges Polysaccharid β-Glucan syn. Gummistoffe und ca. 20% Arabinoxylan (Pentosan)] sowie ca. 3.5-7% Cellulose. Abbauende Enzyme: β-Glucanasen (z.B. Endo-β-(1–>3,1–>4)-Glucanase), Xylanasen und Cellulasen --> Disaccharide Cellobiose, Laminaribiose u.a. Proteasen wie β-Glucan-Solubilase lösen hochmolekulare Zellwandeiweisse auf und bringen damit Hemicellulosen in Lösung) in wässriger Umgebung --> ❺ Lösungsvorgänge (1. mechanisch: Quellen der Stärkekörner, 2. chemisch: Verkleistern der Stärke) --> ❻ Einwirkung von Stärke-Hydrolasen (= α-Amylasen, β-Amylasen, Grenz-Dextrinasen und α-Glucosidasen) --> ❼ Gemisch von Zuckerarten, die meisten vergärbar (= Glucose, Fructose, Maltose, Isomaltose, Saccharose, Maltotriose, aber auch nichtvergärbare Dextrine.
*: cf. Abb. 7 Gerstenkorn hier
Diese komplexen Vorgänge der Zellwandauflösung, an der noch viel mehr Enzyme als oben erwähnt beteiligt sind (z.B. Proteasen, Phosphatasen, Lipasen u.a.), werden ausführlich in Narziss (2009, 2017) beschrieben.
3.2.2. Endogene enzymatische Verzuckerung der Stärke als Grundlage für den nachfolgenden Gärstoffwechsel
Der Brauvorgang besteht im Wesentlichen darin, die nur teilweise oder schlecht lösliche Stärke der Malzkörner, was immer auch als Malz oder Malzmischungen eingesetzt wird (Gerste, Weizen, Roggen, Dinkel, Mais, Reis, u.a. kohlenhydrathaltige Malzersatzstoffe wie Kastanien, Kartoffel oder Früchtezusätze) in durch Hefezellen vergärbare Zuckersubstrate enzymatisch mittels der endogenen während des Mälzens gebildeten endogenen Enzyme zu zerlegen. Stärkemoleküle bestehen aus D-Glucose-Einheiten, die über glykosidische Bindungen miteinander verknüpft sind. Stärke besteht zu 10–30 % aus Amylose, linearen Ketten mit helikaler (Schrauben-)Struktur, die nur α-1,4-glykosidisch verknüpft sind und 70–90 % aus Amylopektin, stark verzweigten Strukturen, mit α-1,6-glykosidischen und α-1,4-glykosidischen Verknüpfungen (Abb. 11).
Abb. 12. Die Wirkung der wichtigsten endogenen stärkeabbauenden Enzyme: α- und β-Amylase, α-Glucosidase und Grenzdextrinase auf Amylose und Amylopektin (cf. Details in Abb. 37 und 38)
Weitergehende Informationen zur Wirkungsweise der wichtigsten Maischeenzyme sind im Anhang dargestellt!
α-Amylase (α-1,4-Glucanase): schneidet innerhalb Amylose-Glucosekette an beliebiger Stelle inkl. Amylopektin an nicht verzweigten Positionen. Produkte: aus Amylose --> G*5-, G6-, G7-Zucker; aus Amylopektin --> verschiedene Oligosaccharide (G6-G9), Dextrine mit Verzweigung.
β-Amylase: schneidet ab Kettenende. Produkte: aus Amylose --> viel Maltose, wenig Maltotriose; aus Amylopektin --> Maltose.
Grenzdextrinase (Pullulanase, α-1,6-Glucanase): schneidet an Amylopektin-Verzweigungsstellen (α-1,6-Übergänge) --> Maltotetrose, Maltotriose, Glucose.
α-Glucosidase (Amyloglucosidase, Glucoamylase) = Maltase: schneidet einzelne Glucosemoleküle von Kettenenden ab, zerlegt auch Maltose. Produkt aus Amylose, Amylopektin, Dextrine, Maltose --> Glucose.
G* = Glucose [Quelle, stark mod.]
Abb. 11. Stärke ist ein Polysaccharid (= Vielfachzucker) und besteht aus der wasserlöslichen Amylose und dem wasserbindefähigen bzw. quellfähigem Amylopektin.
Amylose: Das Polysaccharid Amylose hat eine molare Masse zwischen 100'000 und 1'000'000 g/mol, entsprechend etwa 1000-2000 (bei Getreidestärke) und bis 4500 (bei Kartoffel-stärke) D-Glucose-Einheiten, die α-1,4-glycosidisch miteinander verbunden sind.
Aufgrund der Bindungswinkel zwischen den Bausteinen ist die unverzweigte lineare Kette schraubenförmig zu einer Helix (= Spirale) mit etwa 6 Bausteinen pro Windung gewunden. In den Hohlraum der Helix können andere Moleküle, z. B. Iod als Lugol’sche Lösung, eingeschlossen werden. Daraus resultiert ein tief blau-violett gefärbter Iod-Stärke-Komplex, der als qualitativer Nachweis für Stärke dient bzw. beim Verschwinden dieser Farbe als Nachweis des Stärkespaltung in Zuckereinheiten wie Maltose interpretiert werden kann.
Amylopektin ist der Hauptbestandteil (70–80 %) der natürlichen pflanzlichen Stärke, z. B. der Kartoffel-, Weizen- oder Maisstärke. Das Polysaccharid Amylopektin ist ein Biopolymer mit einer hohen molaren Masse von 10'000'000 bis 200'000'000 g/mol. Die D-Glucose-Einheiten sind dabei α-1,4-glycosidisch miteinander verbunden. Etwa alle 15–30 Monomere ist eine Seitenkette α-1,6-glycosidisch verknüpft, wodurch eine baumartige Verzweigung entsteht. Diese Seitenketten können kurz (mit 12 bis 20 Glucoseeinheiten), lang (30–45 Einheiten) und sehr lang mit durchschnittlich 60 Glucoseeinheiten sein. Aufgrund dieses Unterschiedes in der Struktur bildet Amylopektin auf molekularer Ebene Knäuel- bzw. verzweigte Strukturen aus; die Verzweigungspunkte liegen hauptsächlich am C6-Atom.
[Info als Video].

α-1,4-glycosidische Bindung: das 1. C-Atom des einen Glucose-Moleküls ist mit der OH-Gruppe vom 4. C-Atom des nächsten Glucose-Moleküls verbunden.
α-1,6-glycosidische Bindung: das 1. C-Atom des einen Glucose-Moleküls ist mit der OH-Gruppe des 6. C-Atoms einer anderen Glucoseeinheit verknüpft.
Glycosidische Bindung: chemische Bindung zwischen C-Atomen zweier Kohlenhydrate unter Bildung einer Sauerstoffbrücke; siehe hier, Video.

Neben den zuckerspaltenden Schlüsselenzymen der Amylasen gibt es noch zahlreiche weitere Enzyme, die auf Kohlenhydrate und die anderen Hauptstoffklassen der Proteine und Lipide einwirken. Alle wichtigsten endogenen Enzyme dieser Brauphase beim Maischen sind in der Tabelle Abb. 6 unter brautechnischer Sicht aufgeführt und charakterisiert. Abb. 13 zeigt die wichtigsten Maischeenzyme, deren Temperaturbereiche für optimale Funktion sowie die Inaktivierungstemperatur (--> Denaturierung) und die durch die verschiedenen Rasten, also bei konstanter Optimumstemperatur und definierte Zeitdauer ausgelösten namensgebenden Hauptfunktionen.
Je nach Raststufen (= Idealtemperaturstufe für bestimmte Maischeenzyme) und Rastdauer können die Eigenschaften des entstehenden Bieres beeinflusst werden.
So bewirkt z.B. eine
-
Maltoserast (1. Verzuckerung), 60-68 °C/ optimal 63 °C bei > 30 min bis 45 min/ Inaktivierung bei 70-72 °C: Stärke + β-Amylase –> viel Maltose, wenig Dextrine + Hefegärenzyme –> viel Ethanol: –> Bier hoch vergärend, schlank, weniger süss/trocken = reduzierte Vollmundigkeit.
-
Maltoserast (1. Verzuckerung), 60-68 °C, aber kürzere Dauer < 30 - 90 min –> Stärke –> Dextrine (schwer vergärbar), weniger Maltose: –> Bier mit weniger Ethanol, süss, höhere Vollmundigkeit.
-
Maltoserast (1. Verzuckerungsrast), 60-65 °C/ optimal 60 °C, 10 min/ 72 °C während 45 min, Inaktivierung β-Amylase bei 70-72 °C: Stärke + β-Amylase & α-Amylase –> wenig Maltose, viel kurzkettige Dextrine: –> Bier dunkel und vollmundig.
-
Verzuckerungsrast (2. Verzuckerung, Endverzuckerung), 70-74 °C, optimal 73 °C, Inaktivierung bei 79 °C, 15-45 min: Stärke + α-Amylase –> Dextrine (kurzkettig, unvergärbarer Extrakt), Maltotriose, Maltose: –> Bier mit verstärkter Aromabildung und Vollmundigkeit.
-
Maltaserast, 30-45 °C, optimal 45 °C, 30-60 min: Stärke + Maltase –> Glucose + Hefen –> Ethylacetat + Isoamylacetat: –> Weizenbiere mit Bananenaroma
-
Ferulasäure- bzw. Weizenrast, 40-48 °C, optimal 44 °C, 15 min: Ferulasäure-Pentan-Komplexe + Ferulasäurehydrolase –> Ferulasäure: –> Weizenbiere mit Nelkenaroma.

Abb. 13. Temperaturoptima der Maischeenzyme und die Auswirkungen der dadurch ausgelösten Prozesse.
Grüne Kästchen: beteiligte Enzyme.
Lesebeispiel Maltasen: optimaler Temperaturbereich 30-45 °C, Inaktivierungstemperatur 50 °C durchgestrichen.
Blaue Kästchen: Hauptrastphasen. [Quelle: in Anlehnung an Brücklmeier, 2018]

Abb. 14. Rasten bei mehrstufigen Maischverfahren.
Enzyme werden bei bestimmten Temperaturen optimal aktiviert und werden bei Überschreitung des aktiven Temperaturbereichs denaturiert.
Für den Brauer sind letztlich nur zwei Phasen entscheidend: die Rastphasen der optimalen Kohlenhydratzerlegung oder Verzuckerung in vergärbare und nichtvergärbare Zuckereinheiten.
Letztlich genügt sogar eine Mischtemperatur, bei der sowohl die α-Amylase als auch die β-Amylase aktiv sind (= einstufiges bzw. englisches Infusionsverfahren, syn. Diastaserast; cf. "Brau- und Gärparameter", Abb. 19 hier ). Die übrigen Rasten können zur Akzentuierung bestimmter Bierstile dienen (z.B. Weizenbiere) oder bei speziellen Malzmischungen (z.B. mit geringerem Gerstenmalzanteil).
Mehr Details zu den einzelnen Enzymen sind in der Tabelle Abb. 6 zu finden.
3.3. Gärungsstoffwechsel: Enzyme gewisser Mikroorganismen (Hefe, Milchsäurebakterien) “brauen” Bier
Die Hefen sind reich an Enzymen, die in allen Teilen der Hefezellen wie Zellmembran, Cytoplasma und Zellkern vorkommen (cf. Website Hefen, Abb. 2 hier). Sie bewirken den gesamten Stoffwechsel der Hefen wie Wachstum, Vermehrung und natürlich die Gärprozesse. Der Schwerpunkt dieser Betrachtung liegt auf dem Kohlenhydratstoffwechsel und hier auf der alkoholischen Gärung.
Nach dem Maischen liegt die Bierwürze vor, in der verstoffwechselbare Kohlenhydrate wie Glucose und Fructose (= Hexosen: Monosaccharide [Einfach-zucker], deren Kohlenstoffgrundgerüst sechs Kohlenstoff-Atome enthält), Disaccharide [Zweifachzucker] wie Saccharose [Haushaltzucker = Glucose-Fructose] und Maltose [Glucose-Glucose] und das Trisaccharid [Dreifachzucker] Maltotriose [Glucose-Glucose-Glucose] enthalten sind. Niedrige und höhere Dextrine [auch Stärkegummi oder Maltodextrine genannt, sind homologe Stärkeabbauprodukte mit Molekülgrössen zwischen Oligosacchariden und Stärke] werden von der Hefe nicht aufgenommen. Glucose und Fructose werden durch Diffusion über die Zellmembran aufgenommen und dann nach dem sog. Embden-Meyerhof-Parnas-Weg (= oder einfach Glykolyse = Zuckerspaltung) und der anschliessenden alkoholische Gärung vergoren. Nun, die Alkoholbildung der Hefe ist letztlich kein Genuss für sie, sondern eine Notmassnahme. Warum?
Hefen können als Atmer (Aerobier) oder Gärer (Anaerobier) ihre Lebensenergie gewinnen, sie sind somit sog. fakultative Aerobier. In Gegenwart von Luftsauerstoff gedeihen Hefen prächtig, sie veratmen Zucker zu sehr viel Energie (C6H12O6 + 6 O2 + (32 ADP, 32 Pi) --> 6 CO2 + 6 H2O + 32 ATP, also 32 biologische Universalenergieträger ATP, eine Art “Energiewechselgeld [Info]) und Wasser und CO2. Wird die Luftzufuhr gestoppt, so schalten die Hefen ihren Stoffwechsel auf die “Notmassnahme” Gärung um. Die Gärung ist energetisch ungünstig, liefert sie nur gerade 2 ATP: Anerobe alkoholische Gärung C6H12O6 + (2 ADP, 2 Pi, 2 H+) --> 2 Ethanol C2H5OH + 2 CO2 + 2 ATP + 2 H2O. Um Überleben zu können, muss aber die Hefe ohne Sauerstoff wesentlich mehr Zuckermoleküle verarbeiten (sog. Pasteur-Effekt), weit mehr als unter aeroben Bedingungen, um die Energieverluste zu kompensieren und muss zudem den gebildeten energiereichen Alkohol (= Brennsprit !!) als unnütz ausschütten. Dadurch wird klar, warum die ersten Biotechnologien, die der Mensch nutzte, Gärprozesse waren, die Milchsäuregärung und die alkoholische Gärung: Gärungen liefern enorme Produktmengen in kurzer Zeit, Hefen sind anaerob (gezwungenermassen) hocheffektiv. Und das fiel den frühen Menschen bereits auf, wenn sie etwas kohlenhydratreiches Flüssiges einfach stehen liessen und eine Spontangärung einsetzte ....
Enzyme von der Glucose und bis zum Alkohol
In der Anstellwürze hat es zahlreichengelöste Stoffe, 1. den unvergärbaren Extrakt (Dextrine, Proteine, Gummistoffe, Pentosane, Mineralstoffe, sonstige Stoffe) und 2. den vergärbaren Extrakt, also
• Angärzucker: primär Hexosen (1. Glucose, 2. Fructose [7-9 %]) und 3. Saccharose (Glucose-Fructose [3 %])
• Hauptgärzucker: vor allem 4. Maltose (= Doppelzucker Glucose-Glucose [43-47 %])
• Nachgärzucker: Maltose und 5. Maltotriose (= Dreifachzucker Glucose-Glucose-Glucose [11-13 %]).
Im Folgenden liegt der Schwerpunkt auf dem Hauptstoffwechselweg Glucose –> Ethanol und CO2 bzw. auf den Gärungshauptprodukten. Die zahlreichen Gärungsnebenprodukte wie Höhere Alkohole, Ester, organische Säuren, vicinale Diketone und Schwefelverbindungen würden ein eigenes umfangreiches Informationskapitel bedeuten! Deren Stoffwechselpfade sind natürlich ebenso von zahlreichen Enzymen ermöglicht.
Hefestoffwechsel-Zusatzpfade zur Glykolyse - Die folgenden Substrate werden ebenfalls via die Glykolyse umgewandelt:
-
Fructose: Fructose wird vom Enzym Fructokinase unter ATP-Verbrauch an C1 zu Fructose-1-phosphat phosphoryliert. Fructose-1-phosphat wird danach durch Aldolase B (F-1-P-Aldolase) in Glycerinaldehyd und Dihydroxyacetonphosphat (DHAP) gespalten. Glycerinaldehyd kann dann durch Triosekinase unter ATP-Verbrauch zu Glycerinaldehyd-3-phosphat phosphoryliert werden. Glycerinaldehyd-3-phosphat und DHAP können anschliessend in die Glykolyse eingeschleust werden.
-
Saccharose (= Zucker, Haushaltzucker): Invertase, auch als Saccharase, β-Fructosidase und (veraltet) Invertin bezeichnet, ist ein Enzym, das Haushaltszucker (Saccharose) im Bereich der Hefezellwand bereits in Fruchtzucker (Fructose) und Traubenzucker (Glucose) hydrolytisch aufspaltet.
-
Maltose: Maltose muss zunächst durch ein Transportenzym Maltosepermease in das Zellinnere transportiert werden, wo dann das Enzym Maltase oder α-Glucosidase (auch oft α-Glukosidase) die Spaltung von Maltose (Doppelzucker) in 2 Glucosemoleküle (Traubenzucker) katalysiert.
-
Maltotriose (syn. Maltodextrin): Auch dieser Zucker muss zunächst mittels der Maltotriosepermease ins Zellinnere eingeschleust werden, wo er dann durch Maltase in Glucose gespalten wird.
Der eigentliche Zuckerabbau, die anaerobe Glykolyse ist ein abbauender, energieliefernder Schlüsselstoffwechselweg, dessen Enzyme im flüssigen Teil des Cytoplasma, dem Cytosol lokalisiert sind und der in allen lebenden Zellen (Mensch, Tier, Pflanze, Mikroorganismen) vorkommt. Die Funktion ist der Gewinn von Energie durch den Abbau von C6-Glucose zu C Pyruvat. Dabei wird 1 Molekül Glucose zu 2 Molekülen Pyruvat abgebaut. Die Oxidationsenergie wird in Form von ATP und “gespeichertem Wasserstoff” in Form von NADH konserviert. Die Glykolyse benötigt keinen Sauerstoff, verläuft also anaerob. Die folgende Tabelle in Abb. 15 gibt einen Überblick über die 10 enzymatisch katalysierten Reaktionsschritte der Glykolyse.
Abb. 15. Glykolyse - ein Stoffwechselschlüsselprozess, auch für die alkoholische Gärung.
Unterhalb Tabelle: Ausschnitt Glykolyse aus "Roche - Metabolic Pathways" ab Reaktionsschritt 2.
Abkürzungen:
Pi : anorganisches Phosphat PO4 3- (i: inorganic), Mg2+: Magnesium-Ionen, K+: Kalium-Ionen.
ATP Adenosintriphosphat: biologische Energie-Grundeinheit, ADP: Adenosindiphosphat, “entwertetes” ATP, kann aber wieder “aufgeladen” werden.
NADH+H+: Nicotinamid-Adenin-Dinukleotid-Hydrid, reduzierte Form = Reduktionsäquivalent, d.h. es überträgt zwei Elektronen 2 e- und 1 Proton H+; es ist die biologische Form des gebundenen, aber reaktionsbereiten Wasserstoffs jeder Zelle.
NAD+: oxidierte Form des NADH, “entwertetes” Reduktionsäquivalent, kann aber ebenfalls wieder “aufgeladen” werden.
Die Gesamtgeschwindigkeit der Glykolyse, also dem Zuckerabbau von C6-Glucose zum C3-Pyruvat (syn. Brenztraubensäure) hängt vom Reaktionsschritt 3 ab. Unter anaeroben Bedingungen kann nun das Endprodukte des Zuckerabbaus aus Glucose, zwei Pyruvatmoleküle theoretisch in zwei Gärungsreaktionen weiter verstoffwechselt werden, 1. Der alkoholischen Gärung oder 2. Der Milchsäuregärung. Die Bäcker- bzw. Brauhefen Saccharomyces cerevisiae verfügen nur den Enzymsatz für die alkoholische Gärung (cf. Abb. 16). Die Milchsäurebakterien verfügen über den entsprechenden Enzymsatz der Milchsäuregärung, was Brauer ja benötigen bei Sauerbieren wie Berliner Weisse.
Die beteiligten Enzyme und die Reaktionsschritte der alkoholischen Gärung sind in der Abb. 16 festgehalten.
Eine vereinfachende Darstellung der beiden braurelevanten Gärungen - alkoholische Gärung, Milchsäuregärung - ist in Abb. 17 dargestellt.

Abb. 16. Alkoholische Gärung bzw. Fermentation - unter Sauerstoffausschluss eine der Anschlussreaktionen an die Glykolyse.
Abkürzungen:
TPP: Thiaminpyrophosphat (Vitamin B1-verwandt), übrige Abk. cf. Abb. 15.
Rot: braurelevantes Wissen
Abb. 17. Braurelevante Gärungen.
A: hefegebundene alkoholische Gärung.
B: bakterielle Milchsäuregärung.
Produkte: 2 Ethanol C2H5-OH, 2 CO2, 2 ATP
2 Milchsäure C3H5O2-OH, 2 ATP
[Abkürzungen: cf. Glossar Biochemie.
Quelle: Christian, A., Stoffwechselphysiologie. Schroedel 2006, mod.]

WICHTIGES BRAUWISSEN:
Alle beteiligten Enzyme sind wichtig für den gesamten Brauprozess vom Malz bis zum Bier. Nur die zweite und dritte Hauptphase, Maische und Gärung sind dem Braufachmann direkt zugänglich, also beeinflussbar. Einzelne Enzyme können nicht beeinflusst werden, nur einzelne Enzymgruppen (Maischephase) oder die Gesamtheit der Enzyme (Gärphase). Die Enzymbeeinflussung ist nur summarisch möglich:
-
Flüssigmedien Nährstoffzugaben: durch optimale Zusammensetzung der Hefeflüssigmedien (= Würzelösung, flüssige Gärmedien [Anstellwürze, Rehydrierungsmedien], Anzuchtmedien): Cofaktorenzugabe, z.B. in Form der Hefenahrung/Hefenährstoffe (Hefenahrung, yeast nutrients, z.B. Lallemand Servomyces Nährstoff für Bierhefe [Info], White Labs Yeast Nutrient [Info], Wyeast Beer Nutrient Blend [Info]. cf. 1.2.4 “Abhängigkeit von Cosubstraten und Cofaktoren” hier).
-
Temperaturführung während Maische (Rasten) und Gärung: wie bereits erwähnt, ist die Temperaturführung eine ganz wichtige Stellgrösse für gelingendes Bier sowie für eine gewisse Beeinflussung des Bierstils (cf. Anmerkungen hier). Auch diesem Schlüsselparameter ist ein eigenes Kapitel gewidmet: cf. als “Brau- und Gärparameter” > “Temperatur, Temperaturführung und Gärverlauf” > Fazit hier. Schlüsselabbildungen: Abb. 4: Rasten und Abb. 18: Brauprozesse mit Rastphasen, Abb. 19: Kombirast und Abb. 11: Diacetylrast.
-
pH-Wert-Kontrolle und pH-Einstellung: durch Einstellung des optimalen pH-Wertes während der Maischephasen und Gärphase. Die optimalen pH-Werte für spezifische Enzyme gemäss Tabelle in Abb. 6 können nur als “Summenparameter-pH-Werte” eingestellt werden. Auch diesem Schwerpunktthema ist ein eigenes Kapitel gewidmet als “Brau- und Gärparameter” > “Der pH-Wert im Brauprozess, bei Gärungen und im Bier” cf. hier. Die optimalen pH-Werte während der Brauprozesse sind in Abb. 25 zusammengefasst.
Schlüsselabbildungen: Abb. 21: pH-Toleranzbereiche, Abb. 24: wesentliche pH-Werte Brauprozess, Abb. 25: Optimale pH-Werte Brauprozess.
-
Enzymhemmung: zu hohe Temperaturen (–> Inaktivierung, Denaturierung), ungeeignete pH-Werte (ausserhalb Optimumsbereich) und zunehmende Alkoholkonzentration (Gärendprodukt) beeinträchtigen Umsetzungsgeschwindigkeiten und Funktion der Enzyme.
-
Enzymgaben: eine stockende oder blockierte Gärung infolge ungenügender Stärkeverzuckerung oder zu langkettiger nichtfermentierbarer Zucker kann durch Zugabe von gereinigter α-Amylase deblockiert werden (nicht empfehlenswert, Kontaminationsgefahr).
4. Spezialaspekte
4.1. Enzyme der Aromabildung
Brauhefen können mindestens bis zu 500 verschiedene Aromakomponenten synthetisieren (White, 2010; Annemüller, 2020). Ein sog. Aromarad ist eine eindrückliche Darstellung, um Aromaeindrücke festzuhalten und zu visualisieren (cf. hier). Während der beiden Wachstumsphasen Lag-Phase und exponentielle Wachstumsphase synthetisieren die Hefen Aminosäuren, Proteine und viele andere Zellkomponenten. Die meisten dieser Stoffe beeinflussen das Bieraroma nicht, aber auf deren Stoffwechselwegen werden gewisse Stoffzwischenstufen gebildet, die aus der Zelle entweichen und das Bierarome beeinflussen können. Dazu gehören beispielsweise Ester (z.B. Ethylacetat [lösungsmittelartiges Aroma], Isoamylacetat [bananenartiges Aroma], Isobutylacetat [ananasartiges Aroma], Phenylacetat [rosenartiges Aroma], Ethylcapronat [apfelartiges Aroma], Ethylcaprylat [apfelartiges Aroma]), Fuselalkohole (Begleitalkohole, z.B. Butanol, Hexanol, Isoamylalkohol, Isobutylalkohol, Pentanol, Propanol]), schwefelhaltige Verbindungen (z.B. Schwefeldioxid SO2, Dimethylsulfid C2H6S [DMS], Schwefelwasserstoff H2S, Mercaptane [z.B. Ethanthiol = Ethylmercaptan C2H5SH, Propanthiol C3H7SH]), carbonylhaltige Substanzen wie Aldehyde (z.B. Acetaldehyd H3CHC=O, Trans-2-Nonenal CH3(CH2)5CH=CHCHO), 2-Methyl-Propanal, Isovaleral, 2-Methylbutanal, Phenylacetaldehyd, Benzaldehyd, Methional, Ketone inkl. Diacetyl C4H6O2, organische Säuren (z.B. Essigsäue, Milchsäure, Buttersäure, Capronsäure) und Phenole (z.B. 4-Vinylguajacol, Chlorphenole C6H5ClO [z.B. 2,6-Dichlorphenol]). Einige dieser Substanzen bilden zwar in ausgewogener minimaler Konzentration den typischen Geruch und Geschmack spezifischer Biere (wie Hefeweizen, Rauchbier, gewisse belgische Biere), kippen aber über in einen Bierfehler bei zu hoher Konzentration.
Abb. 18 zeigt grob die Stoffwechselherkunft der wichtigsten Aromakomponenten, während Abb. 19 einen kleinen Ausschnitt aus einem dieser Stoffwechselpfade erahnen lässt, dass ebenfalls zahlreiche Enzyme an diesen Stoffumwandlungen beteiligt sind.
Die Nebenprodukte der Gärung und Reifung, eingeteilt in Jungbierbukettstoffe (Aldehyde, vicinale Diketone, Schwefelverbindungen - eher negativer Einfluss auf die Bierqualität) und Bukettstoffe (höhere Alkohole, Ester, organische Säuren - Vorhandensein und bestimmte Konzentrationen sind Voraussetzung für Qualitätsbiere) sind durch unterschiedliche technologische Massnahmen und die Prozessführung eher schwierig zu beeinflussen (z.B. durch Hefestamm, Hefegabe, Sauerstoffeinfluss, Würzezusammensetzung, Gärtemperatur und Druck). Für den normalen Heimbrauer sind solche Einflussmöglichkeiten nur begrenzt möglich. Ausführlichere Informationen sind in Annemüller, 2020 zu finden.


Abb. 19. Hefe produziert nicht nur Alkohol, sondern auch Aromastoffe.
Aus diesem kleinen Ausschnitt der Bildung von Neben-produkten beim Gärungsstoffwechsel wird ersichtlich, dass noch zahlreiche weiteren Enzyme am “Gesamtkunstwerk Bier” beteiligt sind. Bedingt durch die Komplexität des gesamten Hefestoffwechsels sind die Stoffwechselwege mit den daran beteiligten Enzymen in ihrer Gesamtheit nicht darzustellen. Eine Ahnung davon erhält man höchstens beim Betrachten und Spielen in den “Roche Biochemical Pathways”!!
Hinweis: In der Search-Maske können sowohl Substrat wie Enzyme gesucht und dann auf der riesigen Stoffwechselkarte lokalisiert werden. [Quelle]

WICHTIGES BRAUWISSEN:
FAZIT für BRAUER: Alle diese zahlreichen “aromatischen Enzyme” des Gärungsstoffwechsels und des gesamten übrigen komplexen Hefestoffwechsels sind durch die üblichen Faktoren Temperatur, pH-Wert und die beteiligten Cofaktoren und Cosubstrate beeinflussbar, allerdings kennen wir deren optimalen Einstellungen zur Akzentuierung bestimmter Aromakomponenten nicht im Detail.
Ausnahme: durch Einschaltung einer Ferulasäurerast (= Weizenrast, 40-48 °C, typisch 44 °C, 15 min, cf. Abb. 12+13) bzw. Maltaserast (30-45 °C, 30-60 min, cf. Abb. 12+13 [cf. auch "Brau- und Gärparameter", Abb. 4]) kann die Bildung der weizenbiertypischen Komponente Nelkenaroma bzw. Bananenaroma unterstützt werden!
Wenn sich Fehlaromen gebildet haben, muss auf empirischem Wege der Fehler ermittelt und ausgemerzt werden: siehe dazu die Website “ Brau-/Bierfehler - Fehlaromen” hier.
4.2. Grünmalz
Gersten- oder Weizenkörner werden zum Austreiben in Wasser gegeben. In den Keimlingen entstehen die Enzyme α- und β-Amylase. Diese Enzyme spalten die Stärke, die dem Keimling als erste Nahrungsquelle dient, zu den Zuckern Maltose und Glucose auf. Die in zwei Tagen am Ende der Keimungsphase aufgekeimten Getreidekörner werden als Grünmalz bezeichnet (Info).
In dieser Phase sind die Enzymaktivitäten auf dem Maximum und wenn man einen Teil des Basismalzes durch Grünmalz ersetzt (z.B. 30%), funktioniert das Einmaischen problemlos. Da das Darren etwa 70% der für das Mälzen erforderlichen Energie benötigt, ist die Beimischung von Grünmalz ökologisch und auch wirtschaftlich nachhaltiger als konventionelle Verfahren.
Aber auch rein enzymatisch gesehen ist Grünmalz interessant, wird doch beispielsweise die Aktivität der wärmeempfindlichen β-Amylase beim Darren um bis zu 60% reduziert (Info). Vorteile, aber auch Nachteile des Einsatzes von Grünmalz sind im Artikel “Einsatz von Grünmalz -. Der Enzym-Kick” beschrieben. Grünmalz kann der Heimbrauer nicht beziehen, ausser er wohne in der Nähe einer der seltenen Mälzereien, oder aber er stellt sein Malz als Erweiterung seines Brauhobbys gleich selbst her (Info1, Info2, Info3: Video “How to make malted barley”).
4.3. Industriell im Brauprozess eingesetzte Enzyme (= "exogene" Enzyme)
Im grossem Massstab produziertes Bier sollte kostengünstig, in kurzer Prozesszeit entstehen (höhere Produktivität dank schnellerer Enzymreaktionen), von gleichbleibender Qualität und frei von Fehlaromen sein.
Die Begrenzung durch natürliche Malzenzyme liegt darin, dass diese nur bei bestimmten Temperaturen, pH-Werten und anderen Faktoren arbeiten können und die biochemischen Aktivitäten möglicherweise zu gering sind, um in angemessener Zeit einen optimalen Stoffumsatz zu leisten. So kam der Wunsch nach “exogenen Enzymen” auf, die bei bestimmten Temperaturen und pH-Werten arbeiten, eine höhere Enzymleistung aufweisen oder zusätzliche erwünschte Enzymaktivitäten entfalten, die unter den natürlichen Malzenzymen (cf. Abb. 6) nicht vorhanden sind. Zusammenfassend, die Optimierung des Einsatzes billigerer Rohstoffe, der Verflüssigung von Zusatzstoffen, der Extraktausbeute, der Würzeabtrennung, des Gärprozesses, der Gärleistungen, der Reifezeiten, der Bierfiltrationsraten, der Bieraromen und der Bierstabilität ist ein Dauerziel.
Der Zusatz von exogenen meist aus Mikroorganismen gewonnenen Enzymen macht nun für die industrielle Produktion den Brauprozess daher einfacher, schneller und konsistenter. Er bietet Braumeistern zusätzliche Flexibilität bei der Wahl der Rohstoffe, da sie weniger von Malzenzymen abhängig sind, und bietet die Möglichkeit, neue Produkte zu schaffen, die mit Malzenzymen allein nicht hergestellt werden können.
Weitere Informationen sind auf der informativen Website eines typischen Produzenten von Brauenzymen zu finden: Novozymes. Als Vorteile bei der Verwendung von Enzymen wird hier beispielweise angeführt: 1. definierter Gärungsgrad, 2. kein Buttergeschmack, 3. Abbau verschiedener Stärkesorten, 4. keine Probleme mit Zusatzstoffen und 5. bessere Würzeabtrennung.
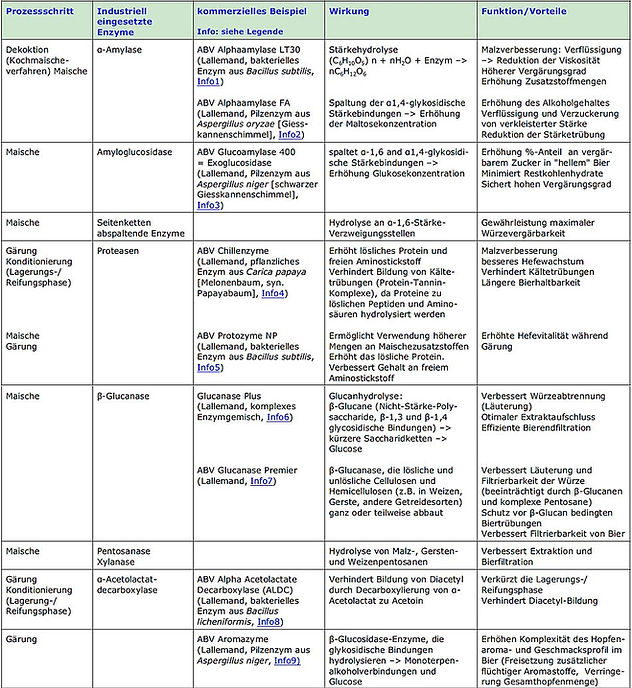
Die folgende Tabelle in Abb. 19 umfasst die wichtigsten exogenen Brauenzyme.
Neben Lallemand gibt es natürlich noch weitere Enzymproduzenten/-Lieferanten, so z.B.
-
Erbslöh: Bier Kompendium > Enzyme bei der Bierherstellung (Tabelle Beerzyme), Produkte Enzyme (cf. Abb. 21).
-
enzymes.bio: https://enzymes.bio/brewing-enzymes/.
-
Novozymes: Enzymes in Brewing Enzymes in Craft Brewing:
-
Attenuzyme® Pro: leistungsstarke Mischung aus Glucoamylase und Pullulanase –> hoher Vergärungsgrad in kurzen Reaktions-zeiten (Info). Pullulanase spaltet α-1,6-Bindungen in Pullulan, Amylopectin and α- and β-Grenzdextrine. Pullulanase wird aus mikrobiellen Quellen gewonnen (Info).
-
Ultraflo® Max: leistungsstarke Mischung aus β-Glucanase und einer Arabinoxylanase –> Abbau beider Hauptzellwand-komponenten ( spaltet β-Glucane und Arabinoxylane in nicht-viskose Poly-saccharide) –> minimale Viskosität, beste Würzeabtrennung und Bierfiltration (Info).
-
Ceremix® Flex: thermostabile maltogene Amylase, Pullulanase und α-Amylase erlauben die Verwendung hochgelatinie-render Zusatzstoffe wie Mais, Reis, Sorghum oder anderen ähnlichen Materialien ohne Getreidekochen sowie glutenfreies Brauen (Info).
-
Maturex® Pro: Maturex® Pro ist ein Acetolactat-Decarboxylase (ALDC)-Enzym, das die Bildung von Diacetyl und 2,3-Pentandion verhindert, indem es die Vorstufen direkt in die geschmacks-neutralen Endprodukte Acetoin und 2,3-Pentandiol umwandelt und so die Reifezeit um 2 bis 14 Tage verkürzt (Info).
-
Ondea® Pro: Ondea® Pro ist eine aus 6 Enzymen bestehende Multi-Enzym-Mischung, die für eine effiziente Viskosität, Trübungsreduzierung, Proteinabbau und kontrollierten Vergärungsgrad sorgt (Info).
Abb. 20: Typisch industriell eingesetzte Brauenzyme ("industrielle Enzympräparate") und kommerzielle Beispiele des bekannten Hefeproduzenten Lallemand. Lallemand-Enzyme: Info.
Info zu kommerziellen Beispielen: Info1, Info2, Info3, Info4, Info5, Info6, Info7, Info8, Info9, Info10.
Anwendung kommerzieller Bierenzyme auch für den Heimbrauer ?
Welches der von der Brauindustrie eingesetzten Enzyme ist auch für den Heimbrauer interessant? Kandidaten wären beispielsweise Enzyme zur schnellen Geschmacksharmonisierung (Diacetylabbau) bei der Reifung des Jungbieres (= Beerzym Rapid), aber auch Glucoamylase (Glucan 1,4-α-glucosidase) für raschen und hohen Vergärungsgrad oder unterstützende Enzyme bei sehr hohen Rohfruchtanteilen (Proteasen).
Nun, da ist zunächst eine grosse Schranke, nämlich die angebotenen Mindestbestellmengen und der damit gekoppelte Preis dieser Enzyme. Häufig werden nur kg-Mengen geliefert oder sie sind (viel) zu teuer (Bsp. Diacetylbildung verhinderndes Beerzym Rapid: Kosten in der Schweiz bei Wenger Getränketechnologie 1 kg CHF 155.80 (Stand 12.01.2022); Beerzym Amyl HT, thermostabile Bakterien-alfa-Amylase zur Stärkeverflüssigung bei der Bierherstellung aus Malz mit Rohfruchtanteilen, flüssig à 1 kg CHF 38.20; Beerzym HopFlower, Aroma-freisetzendes Spezialenzym für die Bierbereitung, flüssig à 1 kg CHF 110.70; Beerzym Amyl HT, thermostabile Bakterien-alfa-Amylase zur Stärkeverflüssigung bei der Bierherstellung aus Malz mit Rohfruchtanteilen, flüssig à 1 kg CHF 38.20 [Info]).
Ausnahmen: White Labs WLN 4000 Clarity Ferm, 10ml, CHF 7.50 [Info, CH-Bezug], Abv Glucoamylase 400, 30mL, CHF 9.50 [Info, CH-Bezug], Lallemand Aromazyme, 100g, €24.95 [Info, Bezug (Brouwland)], Glucoamylase Enzyme For Home Brewing And Commercial Breweries, von enzymes.bio $11.99 (Lieferkosten zusätzlich beachten!).
Aber, angefressene Heimbrauer mit der Leidenschaft nach einer maximal optimierten Lieblingsbiersorte oder neugierige Experimentalbrauer (z.B. Info) scheuen manchmal keinen Aufwand, sodass gewisse Enzyme mit Liefermengen ≤1 kg und Preisen von bis zu CHF 100 doch noch eine Chance haben (vor allem dann, wenn man die dadurch entstehenden Zusatzkosten pro Flasche berechnet ...).

Abb. 21. Enzymeinsatz im gesamten Brauprozess
Beispiel Erbslöh-Produkte.
Grün eingefärbt: Enzyme.

WICHTIGES BRAUWISSEN:
Für den Heimbrauer besteht in der Regel keine Notwendigkeit, zusätzliche exogene Enzyme im gesamten Brau- und Gärungsprozess einzusetzen. Ausnahmen sind höchstens zur Optimierung ausgefeilter Bierrezepte oder bei einem hohen Anteil an Rohfrüchten sinnvoll.
Die Wirkungsweise und Beeinflussung der vorhandenen natürlichen Malz- und Hefe-Gärungsenzyme wird ja bei den mehrstufigen Maischverfahren in Form der verschiedenen Rasten berücksichtigt.
5. Quintessenz "Enzymwissen für Heimbrauer" oder "Enzyme für Spitzenbiere optimieren"
Nicht nur Hefen werden häufig noch zu wenig geschätzt im gesamten Brauprozess - Bierflaschenetiketten führend als Inhaltsdeklaration oft “Zutaten: Wasser, Gerstenmalz, Hopfen” an, auch Enzyme werden von den Brauern zu wenig wertgeschätzt. Ohne Enzyme gäbe es ja kein Bier, Enzyme sind an allen Prozessschritten beteiligt: Mälzen, Maischen, Gärung und Reifung. Zugespitzt formuliert ist Brauen ein enzymatischer Prozess. Grundlegendes Wissen über die Enzyme ist eine wesentliche Grundlage für gutes Bier (und eine gute Wissensbasis gibt dem Brauer ein höheres Selbstwertgefühl ...).
In der Mitte des 19. Jahrhunderts bewiesen Chemiker und Biologen bei der Erforschung der Gärvorgänge die Existenz von Enzymen. 1897 gelang Eduard Buchner als erstem Forscher, in zellfreien Extrakten katalytische Aktivitäten nachzuweisen: filtrierte zellfreie flüssige Hefeextrakte wandelten Zucker in Ethanol und CO2 um (Nobelpreis in Chemie, 1907, cf. diese Website hier). Enzyme wurden lange als Fermente bezeichnet, die lateinische Bezeichnung für „Gärungsmittel“ oder „Sauerteig“. 1878 führte Wilhelm Friedrich Kühne das heutige neoklassische griechische Kunstwort Enzym (ἔνζυμον, enzymon) ein, welches ebenfalls „der Sauerteig“ oder „die Hefe“ bedeutet.
Fazit: Biergleichung = Malzenzyme + Hefeenzyme –-> Bier.
Abb. 22. Enzyme aus Malz und Hefe machen Bier. Braumeister sind Meister im Umgang mit Enzymen.
[Quelle: Verschnitte aus Broschüre "So wird unser vorzügliches Bier gebraut"]
Zusammenfassung "Enzymwissen für Heimbrauer":
Unter Wichtiges Brauwissen sind die grundlegenden praktischen bzw. anwendbaren "Enzym-Erkenntnisse" bereits zusammengefasst. Übersichtshalber und direkt anwählbar (= anklickbar) werden diese hier nochmals tabellarisch dargestellt:
-
Theorie:
Enzyme sind also Schlüsselsubstanzen zu allen Stoffwechselvorgängen und damit zum Leben allgemein. Enzyme sind Eiweisse, die als biochemische Stoffwechselbeschleuniger (= Biokatalysatoren), die letztlich all die Stoffwechselvorgänge im Mälzen, Maischen und Gärung realisieren und dabei selbst nicht umgesetzt werden: Stoff A --ENZYM 1 --> Stoff B -- E2--> Stoff C --E3--> D --E4--> E --> --> --> Stoff X = Endprodukt, z.B. Alkohol, CO2, Aromastoffe. Fazit: "Biergleichung" = Malzenzyme + Hefeenzyme --> Bier.
-
Praxis:
-
Die Temperatur, kombiniert mit dem Zeitfaktor ist ein Schlüsselparameter zur Enzymbeeinflussung bzw. Enzymfunktionsoptimierung und damit für gelingende Maische- und Gärprozesse. Die Beachtung und Steuerung bzw. Regelung der Temperatur bei Brauprozessen ist von grösster Bedeutung!
-
Ausführliche Informationen zur Temperatur auf dieser Website hier !! insbes. zu Gärverläufen hier
-
-
Die Kontrolle und Regelung des pH-Wertes beim Maischen ist der zweite entscheidenste Schlüsselfaktor zum erfolgreichen Brauen und Erzielung von gutem Bier! Eine rasche und genaue pH-Bestimmung bei 25 Grad Celsius ist wichtig (korrekte Technik hier).
-
Ausführliche Informationen zum pH-Wert auf dieser Website hier !!
-
-
Die Substratkonzentration wird indirekt festgelegt durch die Zusammensetzung und Menge der Malzmischung sowie der zugeführten Wassermenge (Hauptguss). Entscheidend sind wohl nur ausreichende erfahrensbasierte Rastzeiten, um die im Überfluss vorhandenen Substrate in die gewünschten Zuckerarten umzuwandeln.
-
-
Die Zugabe von Hefenährstoffen ist nicht zwingend, von Spezialbrauansätzen (z.B. Biere mit hoher Stammwürze, strikt reproduzierbare Gärverläufe) abgesehen, um erfolgreiche Gärungen zu erhalten. Solche Hefenahrungszusätze können aber eine Garantie oder “Versicherung” für reproduzierbare erfolgreiche Gärverläufe und damit deren Produkte sein.
-
-
Das Mälzen ist selten Bestandteil des Hobbybrauer-Repertoires. Also verlassen wir uns auf die Qualität der gelieferten Malze, die heute bei allen Mälzereien sehr hoch ist. Bei der Lagerung im eigenen Keller sollten folgende Punkte beachtet werden, um maximale Enzymaktivitäten beim Maischen zu erhalten:
-
Lagerung: kühl, temperaturkonstant, luftdicht (!) und trocken (keine feuchte Luft aus Malz).
-
Lagerungsfähigkeit: Geschrotete Basismalz ist wasseranziehend und muss deshalb in gut verschliessbaren, luftdichten Behälter gekühlt (oder tiefgefroren) aufbewahrt und möglichst innerhalb von 4 Wochen, spätestens aber nach 3 Monaten verbraut werden (tiefgefroren deutlich länger lagerfähig). Karamellmalze (geschrotet): max. 6 Wochen, Farbmalze (Röstmalze, geschrotet): möglich frisch. Ungeschrotet: max. 1 bis 2 Jahre; bei dunklem Malz bzw. Spezialmalzen max. 3 Monate.
-
Lagermöglichkeiten: offen auf Böden bzw. in Säcken schlecht (Feuchtigkeit, Schädlinge); in Malzkästen (Holz, Stahlblech) oder Weithalstonnen/ Weithalstonnen/ Weithalsfass. Optimal: Bester Aufbewahrungsort von Schrotmalz ist der Kühlschrank, ideal der Tiefkühlschrank.
-
Malzkonditionierung (Wasserzugabe zu ungeschrotetem Malz unmittelbar vor dem Einmaischen): Zugabe von ca. 8 mL Wasser/1 kg Malz, gut einmischen, 1 Std. einwirken lassen, erst dann Schroten. Begründung: weichere Spelzen, bleiben eher unversehrt beim Schroten --> lockern Treber auf, erleichtern das Läutern und erhöhen Sudhausausbeute [Info, Variante Wassernebel]
-
-
-
Alle beteiligten Enzyme sind wichtig für den gesamten Brauprozess vom Malz bis zum Bier. Nur die zweite und dritte Hauptphase, Maische und Gärung sind dem Braufachmann direkt zugänglich, also beeinflussbar. Einzelne Enzyme können nicht beeinflusst werden, nur einzelne Enzymgruppen (Maischephase) oder die Gesamtheit der Enzyme (Gärphase).
-
Die Enzymbeeinflussung ist nur summarisch möglich:
-
Flüssigmedien Nährstoffzugaben: durch optimale Zusammensetzung der Hefeflüssigmedien (= Würzelösung, flüssige Gärmedien [Anstellwürze, Rehydrierungsmedien], Anzuchtmedien): Cofaktorenzugabe, z.B. in Form der Hefenahrung/Hefenährstoffe (Hefenahrung, yeast nutrients, z.B. Lallemand Servomyces Nährstoff für Bierhefe [Info], White Labs Yeast Nutrient [Info], Wyeast Beer Nutrient Blend [Info]. cf. 1.2.4 “Abhängigkeit von Cosubstraten und Cofaktoren” hier).
-
Temperaturführung während Maische (Rasten) und Gärung: wie bereits erwähnt, ist die Temperaturführung eine ganz wichtige Stellgrösse für gelingendes Bier sowie für eine gewisse Beeinflussung des Bierstils (cf. Anmerkungen hier). Auch diesem Schlüsselparameter ist ein eigenes Kapitel gewidmet: cf. als “Brau- und Gärparameter” > “Temperatur, Temperaturführung und Gärverlauf” > Fazit hier. Schlüsselabbildungen: Abb. 4: Rasten und Abb. 18: Brauprozesse mit Rastphasen, Abb. 19: Kombirast und Abb. 11: Diacetylrast.
-
Rasten: die letztlich entscheidenste Einflussmöglichkeit auf die Enzymwirkungen ist die optimale Wahl der Rasten, d.h. den verschiedenen Enzymen ideale Bedingungen bezüglich Temperatur und Einwirkungszeiten zu geben. Damit wird Bierstil und Qualität deutlich beeinflussbar (cf. Detailinformationen in Abb. 13, Tabelle in Abb. 14, Zusatzbemerkungen Bierstil hier, cf. auch unter "Brau- und Gärparameter" hier.
-
pH-Wert-Kontrolle und pH-Einstellung: durch Einstellung des optimalen pH-Wertes während der Maischephasen und Gärphase. Die optimalen pH-Werte für spezifische Enzyme gemäss Tabelle in Abb. 6 können nur als “Summenparameter-pH-Werte” eingestellt werden. Auch diesem Schwerpunktthema ist ein eigenes Kapitel gewidmet als “Brau- und Gärparameter” > “Der pH-Wert im Brauprozess, bei Gärungen und im Bier” cf. hier. Die optimalen pH-Werte während der Brauprozesse sind in Abb. 25 zusammengefasst. Schlüsselabbildungen: Abb. 21: pH-Toleranzbereiche, Abb. 24: wesentliche pH-Werte Brauprozess, Abb. 25: Optimale pH-Werte Brauprozess.
-
Enzymhemmung: zu hohe Temperaturen (–> Inaktivierung, Denaturierung), ungeeignete pH-Werte (ausserhalb Optimumsbereich) und zunehmende Alkoholkonzentration (Gärendprodukt) beeinträchtigen Umsetzungsgeschwindigkeiten und Funktion der Enzyme.
-
Enzymgaben: eine stockende oder blockierte Gärung infolge ungenügender Stärkeverzuckerung oder zu langkettiger nichtfermentierbarer Zucker kann durch Zugabe von gereinigter α-Amylase deblockiert werden (nicht empfehlenswert, Kontaminationsgefahr).
-
-
-
Spezialfälle:
-
Alle die zahlreichen “aromatischen Enzyme” des Gärungsstoffwechsels und des gesamten übrigen komplexen Hefestoffwechsels sind durch die üblichen Faktoren Temperatur, pH-Wert und die beteiligten Cofaktoren und Cosubstrate beeinflussbar, allerdings kennen wir deren optimalen Einstellungen zur Akzentuierung bestimmter Aromakomponenten nicht im Detail. Ausnahme: durch Einschaltung einer Ferulasäurerast (= Weizenrast, 40-48 °C, typisch 44 °C, 15 min, cf. Abb. 12+13) bzw. Maltaserast (30-45 °C, 30-60 min, cf. Abb. 12 + 13 [cf. auch "Brau- und Gärparameter", Abb. 4]) kann die Bildung der weizenbiertypischen Komponente Nelkenaroma bzw. Bananenaroma unterstützt werden! Wenn sich Fehlaromen gebildet haben, muss auf empirischem Wege der Fehler ermittelt und ausgemerzt werden: siehe dazu die Website “ Brau-/Bierfehler - Fehlaromen” hier.
-
-
Für den Heimbrauer besteht in der Regel keine Notwendigkeit, zusätzliche exogene Enzyme im gesamten Brau- und Gärungsprozess einzusetzen. Ausnahmen sind höchstens zur Optimierung ausgefeilter Bierrezepte oder bei einem hohen Anteil an Rohfrüchten sinnvoll.
-
-
Die Wirkungsweise und Beeinflussung der vorhandenen natürlichen Malz- und Hefe-Gärungsenzyme wird ja bei den mehrstufigen Maischverfahren in Form der verschiedenen Rasten berücksichtigt (cf. hier).
-
-
Braubedeutung einzelner Substanzen: siehe im Anhang jeweils die Kurzcharakterisierung der einzelnen chemischen Stoffe!
-
6. Anhang: Die wichtigsten Substrate der endogenen Brauenzyme (Gerstenmalzenzyme) und der Hefen-Gärenzyme
Jedes Enzym ist substratspezifisch, d.h. es erkennt nur "seine" Substanz, die es in einer biochemischen Reaktion verändert. Es wirkt also wie eine Art "molekulare" Sonde und fischt hochpräzise aus den Tausenden im Zellplasma herumschwimmenden gelösten Substanzen sein Molekül heraus und setzt es um. Ein Stoffwechselpfad z.B. vom Zucker Glucose bis zum Alkohol Ethanol setzt eine ganze Reihe von Enzymen voraus (cf. Abb. 14 und 15).
Hefen nutzen ein breites Spektrum an Kohlenhydraten. Jedoch wurde bisher keine Spezies beschrieben, die alle in der Natur vorkommenden Zucker nutzen kann. Einige Beispiele: Die obergärigen Stämme der Hefe Saccharomyces cerevisiae können Glucose, Fructose, Mannose, Galactose, Saccharose, Maltose, Maltotriose und Raffinose nutzen. Die nah verwandte Art Saccharomyces diastaticus und die untergärigen Stämme von Saccharomyces cerevisiae (früher als Arten S. uvarum oder S. carlsbergensis angesehen) nutzen ausserdem Dextrine und Melibiose. Saccharomyces cerevisiae und ihre Verwandten können jedoch nicht Pentosen wie Ribose, Xylose und Arabinose und auch nicht Cellobiose, Lactose, Inulin und Cellulose nutzen (Info, Stewart, 2016).
Im Folgenden werden die wichtigsten Maische- und Gärsubstrate, also Stoffe, die von den Maischeenzymen und Hefeenzymen umgesetzt werden, mit einfachen chemischen Strukturen dargestellt, damit die Wirkungsweise der einzelnen natürlichen (= endogenen) Brauenzyme und Hefeenzyme besser visualisiert werden kann. Dabei kommt den Kohlenhydraten eine entscheidende Rolle zu. Beim Brauen spielen vor allem Zuckerarten eine Schlüsselrolle, so z.B. Glucose, Fructose, Saccharose, Maltose u.a., aber auch Polysaccharide wie Stärke, Cellulose, Glucane, Pentosane u.a. Kohlenhydrate werden unterteilt in (Info)
-
Monosaccharide = Einfachzucker: kleine Moleküle mit 3 bis 7 Kohlenstoffatomen, z.B. Glucose (Traubenzucker), Fructose (Fruchtzucker), Galactose, Ribose. Glucose, Fructose: Angärzucker.
-
Disaccharide = Doppelzucker/ Zweifachzucker: ein aus zwei Monosacchariden bestehendes Molekül, dessen Monomere über eine Glykosidbindung verbunden sind, z.B. Rohrzucker (syn. Haushaltszucker, Saccharose), Maltose (Malzzucker), Lactose (Milchzucker), Cellobiose. Maltose: Hauptgärzucker.
-
Oligosaccharide = Mehrfachzucker: 3 bis 10 über Sauerstoffbrücken glycosidisch verbundene gleiche oder verschiedene Monosaccharide, je nach Anzahl als Tri-, Tetra-, Pentasaccharide etc. bezeichnet, die sowohl linear als auch verzweigt sein können. Bsp.: Maltotriose (syn. Maltodextrin), Raffinose. Maltotriose, (Maltotetraose, Isomaltose): Nachgärzucker.
-
Polysaccharide = Vielfachzucker: durch Verknüpfung vieler Monosaccharide gebildete, hochmolekulare Naturstoffe, z.B. Stärke, Cellulose, Glycogen.
6.1. Monosaccharide: GLUCOSE (Traubenzucker, syn. Dextrose, Brauzucker), FRUCTOSE (Fruchtzucker), MANNOSE und GALACTOSE (Schleimzucker)
Glucose (auch Glukose) wird auch als Traubenzucker oder bei Lebensmittelinhaltstoffen als Dextrose bezeichnet und ist das häufigste Monosaccharid (Einfachzucker) und damit ein wichtiger Grundbaustein der Kohlenhydrate.
In lebenden Organismen ist Glucose (Abb. 23) die Hauptenergiequelle. In Pflanzen ist es als "Vielfach-glucose bzw. Polyglucose" in Form der Stärke gespeichert, in Tieren als Glycogen. Als Baustein der Cellulose ist sie Hauptbestandteil pflanzlicher Zellwände und damit das häufigste Kohlenhydrat überhaupt.
D-Glucose: Es gibt zwei Spiegelbild-Isomere, die D- und L-Glucose. In der Natur kommt ausschliesslich D-Glucose vor.
Zucker bilden lineare Strukturen und innermolekulare Ringe. Beide Konfigurationen stehen in einem Gleichgewicht und können zwischen den Konfigurationen wechseln, indem sie wieder zur offenen Kette und zum Ring in der anderen Konfiguration wechseln. In wässriger Lösung liegt die offene Form nur zu 0,2 % vor. Die Ringform liegt zu 64 % in der β-Form und zu 36 % in der α-Form vor. Die beiden Formen unterscheiden sich nur durch die Stellung der OH-Gruppe am Kohlenstoffatom C1. α-Glucose ist der Baustein der Stärke, β-Glucose ist der von Zellulose. Gehalt in Gerste 0.1%.
Info1 Info2 (Video Monosaccharide)
Braubedeutung: Glucose wird von der Hefe zuerst biochemisch abgebaut und ist damit ein Angärzucker. Typischer Mengenanteil in der Maische: 10-15%. Glucose wird auch zur Karbonisierung in der Nachgärung verwendet (Info1, Info2) oder als Bestandteil der Würze, um den Alkoholgehalt zu erhöhen. Häufigster beim Brauen verwendeter Einfachzucker. Gärfähigkeit: 100%.
Abb. 23. Glucose (Traubenzucker, Brauzucker)
(Sechseck-Ringform, Summenformel, Kohlenstoff-[C]-Nummerierung).
Abb. 24. Fructose
(Fünfeck-Ringform, Summenformel).
Weitere wichtige Einfachzucker neben der Glucose sind die Fructose (Fruchtzucker, Abb. 24), die Galactose (Schleimzucker) und die Mannose (Abb. 25). Alle diese 4 Einfachzucker setzen sich aus den gleichen Atomen zusammen mit der identischen Summenformel C6H12O6, haben aber eine verschiedene räumliche Struktur (= Isomere, Info [Video]).
Braubedeutung: Fructose hat keine Bedeutung für das Maischen. Sie ist in der Gerste mit 0.1% und im Malz nur in sehr geringen Mengen vorhanden (typischer Mengenanteil Malz: 1-2%). Durch den Zusatz von Fruchtsäften, Saccharose, Invertzucker* oder Honig kann sie jedoch in erheblichen Mengen in das Bier gelangen.
*Invertzucker besteht zu gleichen Teilen aus Glukose und Fruktose und wird aus Saccharose hergestellt, indem die glykosidische Bindung durch Enzyme (Invertase) oder die Anwendung von Hitze in einer sauren Umgebung aufgebrochen wird.


Die Mannose (Abb. 25) ist ein Epimer der Glucose (Info). Als D-Mannose ist es eine natürliche Hexose (6C-Monosaccharid) und Baustein zahlreicher pflanzlicher Polysaccharide (Mannane). Im Organismus ist es hauptsächlich Bestandteil von Membranen, in Hefen machen sie als Polymannose (=Mannane) 30-45% der Zellwand aus.
Braubedeutung: Mannose ist kein typischer Bestandteil der Bierwürze. Nach der sog. Lektin-Hypothese wird die Ausflockung der Hefen durch die Bindung von Zymolektinen an Mannosereste von Mannan in der Zellwand von Hefezellen gesteuert. Nährstoffmangel und die Zunahme von Gärungsnebenprodukten (Ethanol und pH-Veränderungen) die Produktion und Aktivierung von Zymolektinen aus (Info). Evtl. kann durch Zugabe von Mannose und Ca2+ am Ende der Sekundärgärung die Hefeflockung beeinflusst werden (Info). Der Mannosepolymer-Gehalt ist in Weizenbieren höher als in Gerstenmalzbieren und soll sich positiv auf die Gesundheit auswirken (Info).

Abb. 25. Mannose
(im Vergleich zur Glucose. Mannose ist strukturell sehr ähnlich wie Glucose).

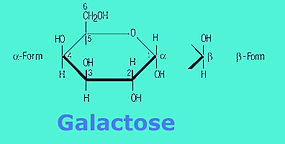
Galactose (Abb. 26) unterscheidet sich von Glucose einzig durch die Ausrichtung der OH-Gruppe am Kohlenstoff 4 (nach oben, cf. Abb. 23 sowie Struktur-Info).
Braubedeutung: Galactose ist für das Maischen ohne Bedeutung, da sie weder im Malz noch in der Würze vorhanden ist. Ihre einzige Auswirkung auf das Brauen liegt in der Zugabe von Lactose (Milchzucker), die aus Glucose und Galactose besteht (cf. Abb. 29), als süsser, aber nicht gärfähiger Zucker für die Herstellung bestimmter Bierstile (z.B.Milchstouts).
Abb. 26. Galactose.
(der "winzige" Unterschied der Stellung der -OH-Gruppe am Kohlenstoffatom 4 macht den Unterschied zur Glucose aus).
6.2. Disaccharide: MALTOSE (Malzzucker), SACCHAROSE (Haushaltszucker, Rohrzucker), LACTOSE (Milchzucker) und MELIBIOSE
Zu den wichtigen "Zweifach-Brauzuckern" gehören Maltose [Glucose-Glucose], Saccharose [Glucose-Fructose], Lactose [Glucose-Galactose] und Melibiose [Glucose-Galactose] mit der für alle gültigen Summenformel C12H22O11 (C6H12O6 + C6H12O6 --> C12H22O11 + H2O).

Abb. 27. Maltose (Malzzucker).
Disaccharid aus Glu-Glu (Glu = Glucose)
Summenformel: C12H22O11 (Info: Video).
Maltose oder Malzzucker ist primär ein Abbauprodukt der Stärke (Gehalt in Gerste: 0.1%). Maltose ist ein Doppelzucker Glu-Glu und ist mit 50%-Anteil der wichtigste Zucker in der Brauwürze. Es handelt sich um einen weissen, kristallinen Zweifachzucker mit der Summenformel C12H22O11. Maltose löst sich gut in Wasser und besitzt einen süsslichen Geschmack (Info).
Braubedeutung Maltose: Durch die Tätigkeit der α-Amylasen des Gerstenkorns wird dessen reichlich vorhandene Stärke beim Maischen hydrolytisch in Malzzucker zerlegt, dem mengenmässig wichtigsten Brauzucker. Dieser Glucose-Glucose-Doppelzucker wird anschliessend beim Gärprozess von Hefen enzymatisch mittels Maltase in Glucose gespalten, die dann anschliessend zu Ethanol und Kohlenstoffdioxid vergärt wird. Diese alkoholische Gärung dient vor allem zur Erzeugung von Bier, Kornbranntwein und Whisky. Die Bedeutung der Maltose kommt auch im Wahlspruch der Brauer zum Ausdruck: „Hopfen und Malz – Gott erhalt’s!“
Saccharose (Haushaltzucker, Kristallzucker, Rohrzucker, Rübenzucker, Sukrose, "Zucker") ist ein Doppelzucker aus Glucose und Fructose, das häufigste Disaccharid in der Natur. In Saccharose sind je ein Molekül α-D-Glucose und β-D-Fructose über eine α,β-1,2-glycosidische Bindung verbunden (Abb. 28).

Braubedeutung: Der Saccharose-Anteil in der Gerste beträgt 1-2%, in der Bierwürze typischerweise 1-3%. Normalerweise verstoffwechseln die Hefen die 1-3fachzucker systematisch in der Reihenfolge Glucose > Fructose > Maltose > Maltotriose. Interessanterweise scheint die Hefe aber zuerst Saccharose aufzubereiten und diesen Zweifachzucker in Glucose und Fructose zu spalten: das Enzym Invertase, auch als Saccharase, β-Fructosidase und (veraltet) Invertin bezeichnet, spaltet hydrolytisch die Saccharose in ihre beiden Einfachzucker auf. Als Bestandteil der Würze wird er eingesetzt zur Erhöhung des Alkoholgehaltes, gleichzeitig aber den Körper des Biers leichter zu machen. Der Haushaltzucker wird vom Hobbybrauer aber primär zur Karbonisierung bei der Nachgärung/ Sekundärgärung eingesetzt (Info). Gärfähigkeit: 100%.
Abb. 28. "Zucker" Saccharose.
Disaccharid aus Traubenzucker und Fruchtzucker.
Summenformel: C12H22O11 (Info: Video).
Lactose (Milchzucker) ist ein Doppelzucker aus den beiden Molekülen D-Galactose und D-Glucose, die über eine β-1,4-glycosidische Bindung miteinander verbunden sind (Abb. 29). Lactose ist eine kristalline, farblose Substanz mit süssem Geschmack; die Süsskraft liegt je nach Konzentration zwischen 25 und 60 % der von Saccharose. Milchzucker ist weniger wasserlöslich als andere Zucker, wie etwa Maltose.

Abb. 29. Lactose (Milchzucker)
Disaccharid aus Schleimzucker und Traubenzucker.
Summenformel: C12H22O11.
Braubedeutung: Die Lactose-Anteil in Malz und Bierwürze ist Null und zugeführte Lactose kann von Hefen nicht verwertet werden, ausser sie wird durch das bakterielle Enzym Lactase in den fermentierbaren Zucker Glucose und die nicht fermentierbare Galactose zerlegt.
Brauer setzen Lactose ein, um dem Bier Süsse, Körper und ein cremiges Mundgefühl zu verleihen. Sie kann verwendet werden, um die bitteren Hopfenaromen in IPAs auszugleichen. Oder um eine subtile Süße hinzuzufügen, die nicht so süßlich ist wie bei malzbetontem Bier (Info, [Anleitung]).
Verwendung: Milk Stouts, Berliner Weisse, Milkshake IPA, Gose, Sauerbiere u.a. (cf. Info).
Melibiose ist ein reduzierendes Disaccharid, das durch eine α-1,6-Bindung zwischen Galaktose und Glukose (D-Gal-α(1→6)-D-Glu) gebildet wird. Die meisten Hefestämme von Saccharomyces ssp. sind nicht in der Lage, Melibiose zu vergären.
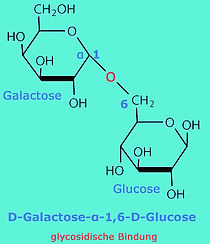
Abb. 30. Melibiose
Disaccharid aus Schleimzucker und Traubenzucker.
Summenformel: C12H22O11.
Braubedeutung: Melibiose kommt nur in geringsten Mengen in der Bierwürze vor.
Der Zucker Melibiose wird durch das Enzym α-Galactosidase A - auch Melibiase genannt - in die Komponenten Glucose und Galaktose gespalten, wie zum Beispiel durch den Hefe-Pilz Saccharomyces pastorianus (untergärige Lager-Hefe, auch: Saccharomyces carlsbergensis). Da die bekannte Bäckerhefe (Bier-Hefe, Saccharomyces cerevisiae) dieses Enzym nicht besitzt, kann die Melibiose als Testsubstanz zur einfachen Unterscheidung beider Arten eingesetzt werden (Info).
6.3. Trisaccharide: MALTOTRIOSE und RAFFINOSE
Maltotriose ist ein Trisaccharid und besteht aus drei Glucose-Molekülen, die mit einer α-1,4-Glycosidbindung verkettet sind. Maltotriose kann aus nativer Stärke (z. B. Maisstärke) durch Amylolyse gewonnen werden (--> Maissirup). Maltotriose ist ein weisser, kristalliner Feststoff, der löslich in Wasser ist.
Braubedeutung: Der Maltotriose-Anteil in der Bierwürze ist recht hoch und liegt bei 15-20%. Maltotriose entsteht durch β-Amylaseeinwirkung auf die α-Amylase Stärkekurzketten. Sie ist typischerweise die letzte Zuckerart, die vergärt wird in der Reihenfolge Saccharose --> Glucose --> Fructose --> Maltose --> Maltotriose.
Mehrfachzucker, die aus mehr als drei Zuckermolekülen bestehen, können von Bierhefen nicht mehr vergoren werden.

Abb. 31. Maltotriose
Trisaccharid aus 3 Molekülen Glucose.
Summenformel: C18H32O16.

Raffinose (syn. Melitriose, Melitose) ist ein in Pflanzen vorkommendes Trisaccharid. Die Raffinose besteht aus den drei Einfachzuckern Galactose, Glucose und Fructose. In manchen Pflanzen ersetzt die Raffinose die Stärke als Speicherkohlenhydrat. Raffinose besitzt nur 22 % der Süsskraft von Saccharose, da mit zunehmendem Polymerisationsgrad Saccharide zunehmend geschmacksneutral werden. Der Gehalt in der Gerste beträgt 0.3-0.5%. (Zusatzinfo).
Abb. 32. Raffinose
Trisaccharid aus 3 verschiedenen Monosacchariden.
Summenformel: C18H32O16.
Braubedeutung: Raffinose fehlt in der Bierwürze.
Die untergärigen Brauhefen vergären das Trisaccharid vollständig. Von den obergärigen Hefen wird das Raffinosemolekül nur zu einem Drittel verwertet. Ursache: es fehlt ihnen das Enzym Melibiase, welches das nach Abspalten der Fructose vorliegende Disaccharid Melibiose (Abb. 29) weiter in Glucose und Galactose zu zerlegen vermag.
Dieser interessante Unterschied zwischen beiden Hefearten ist genetisch bedingt (Info).
6.4. Polysaccharide: DEXTRIN und MALTODEXTRIN, STÄRKE, CELLULOSE und NICHTSTÄRKEARTIGE POLYSACCHARIDE (Video, Info)
Dextrin (Stärkegummi) und Maltodextrin sind homologe Stärkeabbauprodukte, deren Molekülgrösse zwischen Oligosacchariden und Stärke liegen. Maltodextrin ist eine Kombination aus drei bis siebzehn D-Glucoseeinheiten, die hauptsächlich mit α (1 → 4) glycosidischen Bindungen verknüpft sind (Abb. 34). Seine chemische Formel lautet C6nH(10n + 2)O(5n + 1). Das Dextrin-Äquivalent von Maltodextrin umfasst 3 bis 20-Glucosemoleküle. Dextrin (Abb. 33) ist eine Kombination aus D-Glucoseeinheiten, die hauptsächlich mit α (1 → 4) oder α- (1 → 6) glycosidischen Bindungen verknüpft sind. Seine chemische Formel lautet (C6H10O5) n. Mit 4-10 Glucose-Einheiten (G4-G10) sind die Dextrine noch löslich, G11-G40 als sog. Erythrodextrine bereits unlöslich (mit Jodtinktur fliessend rot-purpur-blau) und G40-G<100 sowieso unlöslich (mit Jodtinktur blaufärbend).

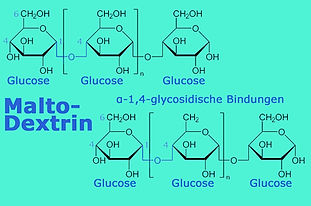
Dextrine/ Maltodextrin
Braubedeutung: Maltodextrin/Dextrine sind nicht vergärbar. Ihr Anteil in der Bierwürze ist recht hoch mit total ca. 20-30% (niedere D., G4-G9: 6-12%, höhere D., G8-G34: 19-24%). Maltodextrin wird enzymatisch aus Weizen- oder Gerstenstärke gewonnen. Im Brauprozess wird er zur Erhöhung des Stammwürzegehalts, der Verbesserung der Vollmundigkeit und des Körpers und zur Schaumbildung eingesetzt. Zugabe von Dextrinmalz bei Lager- und Alebieren (detaillierte Info dazu hier).
Abb. 33. Dextrin
Dextrin ist ein kurzkettiges Kohlenhydrat und seine Monomereinheit ist D-Glucose, die hauptsächlich mit
α (1 → 4) oder α- (1 → 6) glycosidischen Bindungen verknüpft sind. Summenformel: (C6H10O5)n, n = 3-20.
Abb. 34. Maltodextrin
3 bis 17 D-Glucoseeinheiten sind mit α-1,4-glycosidische Bindungen miteinander verknüpft.
Summenformel: C6nH(10n+2)O(5n+1), n=3-17.
Malz ist kurz gekeimtes und wieder getrocknetes Getreide (Braugerste, Weizen, Roggen, Dinkel, Mais, Reis o. a.).
Stärke ist das mengenmässig wichtigste Substrat im Malzkorn (65-68% im Gerstenkorn). Die Stärke kann aber nur im Brauprozess (Maische, Gärung) genutzt werden, wenn sie gelöst und abgebaut wird. Dies läuft über mechanische, chemische und enzymatische Teilvorgänge ab, nämlich 1. Quellung der Stärkekörner, 2. Verkleistern der Stärke und 3. enzymatischer Stärkeabbau (= Verzuckerung). Die Getreidestärke bzw. Malzstärke besteht aus zwei strukturell verschiedenen Komponenten, der Amylose und dem Amylopektin (Info: Video, Info)


Abb. 35. Amylose
17-24% der Malzstärke besteht aus der geradkettigen Amylose.
Amylose ist ein vorwiegend lineares Polysaccharid mit der Summenformel (C6H10O5)n, das aus 60 bis 2'000 α-1,4-glycosidisch gebundener Glucose-Einheiten besteht und eine unverzweigte spiralig verkettete Struktur bildet.
Abb. 36. Amylopektin.
76-83% der Malzstärke besteht aus Amylopektin.
Amylopektin ist ein verzweigtes Polysaccharid mit der Summenformel (C6H10O5)n, das aus 1 bis 6 Millionen zu 95% aus α-1,4- und zu 5% aus α-1,6-glycosidisch gebundener Glucose-Einheiten besteht. Etwa alle 7–8 Glu-Monomere ist im Innern eine Seitenkette α-1,6-glycosidisch verknüpft, etwa alle 13-15 Glu-Einheiten im äussern Bereich, wodurch eine baumartige Verzweigung entsteht. Diese Seitenketten können kurz (mit 12 bis 20 Glucoseeinheiten), lang (30–45 Einheiten) und sehr lang mit durchschnittlich 60 Glucoseeinheiten sein (Info).
Abb. 35 - Fortsetzung.
Die Amlyose wird, gleich wie das Amylopektin, von der α-Amylase an willkürlichen Stellen gespalten. Minimal ist jedoch ein Glucose-Trimer notwendig, weshalb als Produkte Maltose und Glucose entstehen. α- und β-Amylasen können Amylose vollständig hydrolysieren (--> Maltosen).
Eigenschaften: Wasserlöslich: Sol-bildend bei Zimmer- temperatur, Gel-bildend bei 50-60 °C, weniger wasser-löslich als Amylopektin. Jodtest: tiefblaue Farbe.
Braubedeutung: Stärke als "Polyglucose" mit den beiden Varianten Amylose und Amylopektin liefert nach einem enzymatischen Abbau dank vielen amylolytischen Malzenzymen den idealen Grundbaustein der alkoholischen Gärung, die Glucose.
Weitere enzymatische Stärkeabbauprodukte wie Dextrine tragen zu einem abgerundeten Biertrinkerlebnis wie Körper und Vollmundigkeit bei.
Cellulose ist ein nichtstärkeartiges Polysaccharid mit einem mengenmässigen Anteil in der Gerste von etwa 3.5-7%. Sie befindet sich als Gerüstsubstanz in den Spelzen, aber nicht im Mehlkörper des Gerstenkorns. Cellulose baut sich aus β-1,4-glycosidischen Glucoseeinheiten auf (Abb. 37). In wässriger Umgebung ist die Cellulose unlöslich.

Weitere nichtstärkeartige Polysaccharide
Die nichtstärkeartigen Polysaccharide machen insgesamt mengenmässig ca. 10-14% der Gerste aus. Neben der Cellulose sind auch die sog. Hemicellulosen (syn. Cellulosane) wichtige Komponenten der strukturlosen Füllmasse (Matrix) der jungen Zellwand (Bausteine der Hemicellulosen: Pentosane [C5: Xylose, Arabinose] und Hexosane [C6: Mannose, Galactose, Glucose]). Beispiel Arabinoxylan, Abb. 38.
Zu den Hemicellulosen gehören auch die sog. Gummistoffe, das sind wasserlösliche aus β-Glucan (aus Getreide aus β-1,3- und β-1,4-verknüpften D-Glucose-Einheiten) und Pentosan (Arabinoxylan: Arabinose-Xylose) bestehende Kohlenhydrate, die in Wasser bei einem Mengenteil von variablen 2% kolloide Lösungen von hoher Viskosität bilden.
Auch die Protopectine, die dritte wichtige Kohlenhydratgruppe der Zellwände, bestehen aus verschiedenen Zuckerbausteinen (Protopectin: Galacturonsäure-ketten mit angehängten Rhamnose [C6]-, Galactose- und Arabinose [C5]-Zuckern).
Der Aufbau der pflanzlichen Zellwände aus diesen drei Hauptkomponenten Cellulose, Hemicellulose und Protopectine ist hier grafisch dargestellt.
Abb. 37. Cellulose - ein Nicht-Stärke-Polysaccharid.
Cellulose ist ein Polysaccharid, an den dessen Aufbau nur ein einziger Zucker beteiligt ist, und zwar ein fast identische Zucker wie bei der Stärke, nämlich die D-Glucose (cf. Unterschied zwischen natürlicher D- und künstlicher L-Glucose hier), aber in der β-Form.
Zwei β-D-Glucosemoleküle sind mit (1-4) glycosidischer Bindung verbunden, wodurch Cellobiose gebildet wird, und ausserdem wird Cellulose hergestellt, die chemisch und durch Enzyme nur schwer zersetzt werden kann. Die β-Form ist stabiler als die α-Form (Info). [Quelle: Lüttge, mod.]
Abb. 38. Hemicellulose Arabinoxylan.
Arabinoxylan (Pentosan, Schleimstoffe) ist eine Hemicellulose, die in pflanzlichen Zellwänden vorkommt wie Getreidepflanzen. Es ist das zeithäufigste Polysaccharid in der Gersten-Endospermzellwand. Arabinoxylan besteht aus Copolymeren zweier Pentosen (C5-Zucker), Arabinose (syn. Pectinose, Gummizucker), ein Einfachzucker mit Summenformel C5H10O5) und der Xylose (syn. Holzzucker, ebenfalls ein Einfachzucker mit der identischen Summenformel C5H10O5).
Arabinoxylane bestehen aus zahlreichen kettenförmig 1,4-verknüpften Xylose-Monomeren. Viele dieser Xylose-Einheiten sind einfach mit 2- oder 3- bzw. zweifach mit 2,3-verknüpfter Arabinose substituiert.
Malzinhaltsstoffe wie β-Glucane und Arabinoxylane wurden als hemmende Substanzen innerhalb des Läuterprozesses identifiziert. [Quelle, Info1, Info 2]
An Arabinoxylan ist auch Ferulasäure gebunden, vor allem in den Spelzen und im Aleuron (Trennschicht äussere Schale - Mehlkörper, cf. Abb. 7, Pkt. 9 hier). Durch den Abbau des Arabinoxylans durch die Endo- und Exo-Xylanasen (Xylanasen-Aktivität: Abbau des Xylose-Rückgrats in Arabinoxylan, Optimum 45 °C) und Arabinosidasen (Arabinofuranosidase: Abspaltung von Arabinose-Seitenketten vom Xylose-Rückgrat); Feruloyl-Esterase: spalten Ferulasäure-Seitenketten vom Molekül ab; 40–45 °C) wird die Ferulasäure freigesetzt.
Braubedeutung: Weizenbierhefen (und nur diese) haben die Eigenschaft, aus der Ferulasäure als Vorläufer das 4-Vinylguajacol zu bilden, welches als typisches Weizenbieraroma gilt und an Gewürznelke erinnert.



Abb.39. Gersten-β-Glucan.
β-Glucane sind polymere Kohlenhdrate aus β-D-Glucose-Einheiten, die durch 74% β-1,4- und 26% β-1,3-Bindungen miteinander verbunden sind. Beta-Glucane kommen in der Kleie von Getreide wie Gerste und Hafer vor. Das Gersten-β-Glucan ist in den Zellwänden mit Proteinen gekoppelt. Als Gerüst- und Stützsubstanzen werden sie beim Maischen nur teilweise abgebaut (--.> Glucandextrine), also in Lösung überführt, was beim Abläutern und bei der kommerziellen Bierfiltration zu Problemen führen kann.
Braubedeutung: Cellulose und weitere nichtstärkeartige Polysaccharide sind nicht vergärbar, aber sie beeinflussen den Maischebrauprozess:
-
höhere Anteile der Nichtstärke-Polysaccharide im Malz beeinflussen die Viskosität sowohl der Bierwürze als auch des fertigen Bieres und damit auch der Würzeabtrennung (Läuterprobleme) und Bierfiltration
-
Gummirast, 35-40 °C: Rast für Endo-β-(1-->3, 1-->4)-Glucanasen für den Abbau von Nicht-Stärke-Polysacchariden (Hemicellulose mit hochmolekularem β-Glucan --> Glucangummi --> Glucandextrin, cf. Abb. 6 und Abb. 19) bei Rohfrüchten (= nicht enzymatisch-vergärbare Substanzen wie z.B. Mais, Reis, ungemälzter Roggen oder Weizen)
-
Fruchtbiere/ungemälzte Rohfrüchte: um an die vergärbaren Zucker heran zu kommen, müssen die Zellwände zunächst mechanisch aufgebrochen werden durch z.B. Gefrieren - Auftauen - Zerquetschen.
6.5. Stärkeabbau durch endogene amolytische Enzyme (Verzuckerung)
Stärke existiert als Poly-Glucose-Molekül in aufgewickelter bzw. spiralisierter Form = Amylose (Abb. 34). Die Zuckerkette ist schraubenförmig zu einer Helix mit etwa 6 Bausteinen pro Windung gewunden. Der Hauptanteil der Gerstenstärke ist jedoch in der verzweigten Amylopektin-Struktur vorhanden (Abb. 35). Die beiden Abbildungen 40 und 41 geben einen Überblick über die wichtigsten enzymatischen Abbauprozesse der Stärke- und deren Kohlenhydrat-reststücke, der Amylolyse.
Abb. 40. Enzymatischer Abbau der Amylosestärke durch Malzenzyme.
Die Amylose wird, gleich wie das Amylopektin (Abb. 41) von α-Amylasen von innen her (= Endoenzym, Endo-Amylase, Dextrinogen-Amylase [Symbol: blaue Schere] an willkürlichen Stellen in kürzere Ketten aufgespalten und bilden Oligosaccharide mit 5, 6 und 7 Glucoseeinheiten (G5-G7, syn. Oligodextrine). Minimal ist jedoch ein Glucose-Trimer Glu-Glu-Glu notwendig, weshalb als Produkte auch Maltose und Glucose entstehen können.
Erst bei längerer Einwirkungsdauer werden auch G3 bis G1-Zuckereinheiten wie G2 Maltose und G1 Glucose gebildet.
Fazit α-Amylasen --> G5-G7 Dextrine --> Maltotriose, Maltose, Glucose.
Die β-Amylasen (= Exoamylase [Symbol: gelbe Schere]) bauen die Stärkeketten vom Ende her ab und zwar jeweils um 2 Glucose-Einheiten am Stück, also Maltosen (Glu-Glu). Es fallen aber auch C1-Glucose und C3-Maltotriose-Moleküle Glu-Glu-Glu an.
Fazit β-Amylasen --> Maltose (Maltotriose, Glucose).
α-Amylasen und β-Amylasen können Amylose, im Gegensatz zu Amylopektin vollständig hydrolysieren.
Maltasen (syn α-Glucosidase, Maltase-Glucoamylase [Symbol: rote Schere]) lösen α-1->4, α-1->3, α-1->2, α-1->6 und α-1->1-Bindungen. Sie schneiden somit als einzige Malzenzyme direkt einzelne Glucosemoleküle von Glucose-Kettenenden ab und damit am bevorzugten Doppelzucker Maltose direkt gemäss Glu-Glu ---> Glu + Glu zwei einzelne Glucosemoleküle. Optimaler Wirkungsbereich in der Maische: pH 6.0, Temperatur 35-45 °C, Inaktivierung > 50 °C.
Fazit Maltase --> Glucose.
Die Produkte des enzymatischen Amyloseabbaus in der Anstellwürze sind im grünen Bereich zu sehen.
[Quellen: in Anlehnung an Narziss (2017), Brücklmeier (2018) und Basarova (2017), stark mod.]


Abb. 41. Enzymatischer Abbau der Amylopektinstärke.
Die α-Amylasen [Symbol: blauer Pfeil] bauen das verzweigte Amylopektin innerhalb der Polyglucosekette nur an den α-1,4-Bindungen zu verschiedenen kleineren G6-G9-Oligosacchariden und zu eher schwer abbaubaren α-Grenzdextrinen mit α-1,4-Bindungen und mit einer oder mehreren α-1,6-Verzweigungen ab. Die spätere Spaltung zu Maltose erfolgt langsam. Optimale Wirkungsbereiche der α-Amylasen in der Maische: pH 5.6-5.8, Temperatur 72-75 °C, Inaktivierung > 80 °C.
Fazit α-Amylasen --> Dextrine, Maltotriose, Maltose, Glucose.
Die β-Amylasen [Symbol: gelber Pfeil] bauen Amylopectin ebenfalls nur an den α-1,4-Bindungen zu etwa 50% ab. Sie spalten Maltoseeinheiten ab und stoppen jeweils 2 bis 3 Glucoseeinheiten vor einer α-1,6-Verzweigung und bilden somit auch Grenzdextrine. Optimale Wirkungsbereiche der β-Amylasen in der Maische: pH 5.4-5.6, Temperatur 60-65 °C, Inaktivierung > 60 °C.
Fazit β-Amylasen --> Maltose, (Maltotriose, Glucose), zusammen mit α-Amylasen maximal 80%. Rest: ca. 20% Grenzdextrine mit α-1,6-Bindungen.
Die Grenz-Dextrinase [Symbol hellroter Pfeil] löst α-1,6-Bindungen des Amylopektins bzw. primär der durch α- und β-Amylasen freigesetzten Grenzdextrine mit Verzweigungen. Optimaler Wirkungsbereich in der Maische: pH 5.1, Temperatur 55-60 °C, Inaktivierung > 65 °C.
Fazit Grenzdextrinase --> lineare Dextrine (syn. Stärkegummi oder Maltodextrine, Abb. 32 + 33), Glucose, Maltose, Maltotriose, Maltotetrose. Weiterer Abbau durch Amylasen.
Maltasen [Symbol roter Pfeil] spalten bevorzugt aus Maltosen direkt einzelne Glucoseeinheiten ab. Nur zu Beginn der Maischephase optimal aktiv bei Temperaturen zwischen 35-40 °C.
Fazit Maltase --> Glucose. [Quellen: in Anlehnung an Narziss (2017), Brücklmeier (2018) und Basarova (2017), stark mod.]
6.6. Stärke- und Zellwand-abbauende hydrolytische Enzyme - stark vereinfachte Darstellungen
Um einen einfachen Überblick zu den wichtigsten im Brauprozess wirksamen Enzymen zu erhalten, wird jeweils die typischste Reaktion des jeweiligen die Stärke oder die Zellwandkomponenten abbauenden Enzmys mit einer vereinfachten Substratstruktur dargestellt [Quelle: Megazyme, mod.].
Abb. 42. Stärke-abbauende α-Amylase.
Die Struktur des Vielfachzuckers Stärke ist links jeweils für Amylose und Amylopektin angedeutet.
α-Amylase liefert viele Dextrine. Produkte des α-Amylase-Abbaus sind hier nur aber exemplarisch dargestellt.

Abb. 43. Stärke-abbauende β-Amylase.
β-Amylase liefert viel Maltose. Die Produkte des β-Amylase-Abbaus sind hier aber nur exemplarisch. dargestellt.


Abb. 44. Stärke-abbauende Grenzdextrinase.
Grenzdextrinasen spalten Verzwiegungen in Dextrinen. Produkte des Grenzdextrinase-Abbaus sind hier nur exemplarisch dargestellt.
Abb. 45. β-Glucan-abbauende
β-Glucanasen und Cellulasen (Info)
β-Glucanasen spalten β-1,4-Bindungen der β-Glucanketten in Glucandextrine und das Disaccharid Cellobiose (syn. Cellose) aus zwei β-1,4-glycosidisch verknüpften Glucose-molekülen. Eine Glukanrast (syn. Gummirast, cf. Abb. 13 + 14) kann bei Läuterproblemen und hohem Rohfruchtanteil von Nutzen sein.
Sie sind während des Mälzens hauptsächlich in Bezug auf den Lösungsprozess von Bedeutung, da sie die Zellwände des Gerstenendosperms abbauen. Diese Enzyme werden wie die α-Amylase bzw. Proteinasen vor allem während des Keimprozesses gebildet. Im Verlauf des Maischens erfolgt ein weiterer Abbau der Gummistoffe und Hemicellulosen durch Endo-β-Glucanasen, was die Viskosität der Würze vermindert.
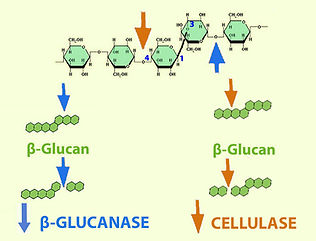
Abb. 44 Fort. Cellulasen hydrolysieren β-1,4-Bindungen in Cellulose (cf. Abb. 37) und β-Glucan.

Abb. 46. Arabinoxylan-abbauende Xylanasen
Endo-Xylanasen spalten hydrolytisch β-1,4-Bindungen des Xylose-Rückgrats des Arabinoxylans, nicht aber die α-gebundenen Arabinosenzucker (blaue "Anhängsel" in Grafik, vgl. auch Abb. 38).
Literatur/Quellenangaben zu Enzymen allgemein und brautechnisch
- Annemüller, G., Manger, H-J., Gärung und Reifung des Bieres. Grundlagen, Technologie, Anlagentechnik. 3. Aufl. (2020). VLB, Berlin.
- Basarova, G., Savel, J., Basar, P., Basarova, P., Lejsek, T., The Comprehensive Guide to Brewing, From Raw Material to Packaging. 1. Aufl. (2017). Fachverlag Hans Carl,
Nürnberg.
- Bisswanger, H., Enzyme. Struktur, Kinetik und Anwendungen. 1. Aufl. (2015). Wiley-VCH, Weinheim.
- Brittney, Christianson, Yeast Nutrition: Feed your yeast to ensure success. Brew You Own, Sept. 2020.
- Brücklmeier, J., Bier Brauen. Grundlagen, Rohstoffe, Brauprozesse. 1. Aufl. (2018). Eugen Ulmer, Stuttgart.
- Christian, A., et al., Stoffwechselphysiologie (Materialien SII Biologie). (2006). Schroedel Verlag/Westermann, Braunschweig.
- Farber, M., Barth, R., Mastering Brewing Science. Quality and Production. 1. Aufl. (2019). John Wiley & Sons, Hoboken, NJ, USA.
- Fritsche, O., Biologie für Einsteiger. 2. Aufl. (2015). Springer-Verlag, Berlin/Heidelberg.
- Krüger, J., Vom Korn zum Malz. Brau!magazin, Winter (2014/15).
- Krüger, J., Malzübersicht. Brau!Magazin, Winter (2014/15).
- Kunze, W., Hendel, O. (Hsrg.), Technologie. Brauer & Mälzer. 11. Aufl. (2016). VLB, Berlin.
- Lüttge, U., Kluge, M., Bauer, G., Botanik. 5. Aufl. (2005). Wiley-VCH Verlag, Weinheim.
- Megazyme, Enzymes and beermaking. Streamlining enzyme analysis in brewing 04/19 (Info)
- Narziss, L., Back, W., Die Bierbrauerei. Band 2: Die Technologie der Würzebereitung. 8. Aufl. (2009). Wiley-VCH Verlag, Weinheim.
- Narziss, L., Back, W., Gastl, M., Zarnkow, M., Abriss der Bierbrauerei. 8. Aufl. (2017). Wiley-VCH Verlag, Weinheim.
- Palmer, J.J., Erfolgreich Bier brauen. Ein Ratgeber für Anfänger und Fortgeschrittene. 1. Aufl. (2019). Mobiwell Verlag, Immenstadt.
- Probst, W. (Hrsg.), Biologie Lehrbuch SII. 1. Aufl. (2007). Duden Paetec, Berlin.
- Renneberg, R., Süssbier,, D., Berkling, V., Loroch, V., Biotechnologie für Einsteiger. 5. Aufl. (2018). Springer Spektrum, Springer Verlag, Berlin.
- Sheppard, J.D. (Ed.), Introduction to Brewing and Fermentation Science. 1. Aufl. (2021). World Scientific Publishing, Singapore.
- Stewart, G.G., Saccharomyces species in the Production of Beer. Beverages 2016, 2, 34 (Info).
- White, C., Zainasheff, J., Yeast. The Practical Guide to Beer Fermentation. 1. Aufl. (2010). Brewers Publications, Boulder CO, USA.
Quellenangaben zu industriellen Enzymen
Aerts, G., Chapelle, G., Brauen mit Grünmalz - neues Schrotverfahren. GradPlato (2021).
Gomaa, A. M., Application of Enzymes in Brewing. Journal of Nutrition and Food Science Forecast, 26 Jan. (2018)
Leclercq, G., Einsatz von Grünmalz - der Enzym-Kick. GradPlato (2020).
Parkes, S., Understanding enzymes. BYO, September (2001).
Windhausen, A.B., Practical Enzymatic Brewing. Craft Brewers Conference (2020).
Infoquellen Internet: Überblick
https://biosolutions.novozymes.com/
Bottleneck Management:
https://www.bottleneckmgmt.com/
Lallemand Brewing Enzymes:
https://www.lallemandbrewing.com/
Enzymes and beermaking:
https://prod-media.megazyme.com/
Practical enzymatic brewing:
https://www.brewersassociation.org/
Enzymes in the Brewing Process:
https://www.murphyandson.co.uk/
Enzymes Used In The Brewing Process:
https://infinitabiotech.com/
Megazyme - Malting, Brewing and Distilling Enzymes:
Increasing Flavor and Aroma:
https://www.lallemandbrewing.com/
Bezugsquellen "industrieller" Enzyme
-
Schweiz: Wenger Getränketechnologie, Route de l'Industrie 36, CH-1615 Bossonnens, Tel +41 (0)21 947 44 10, info@wengertechnologie.ch,
Enzyme Bier, Bierbehandlung - Wenger Getränketechnologie (wengertechnologie.ch)
Brau- und Rauchshop GmbH, Hauptstrasse 1, CH-5026 Densbüren, Tel +41 (0)56 666 35 18, Kontakt-eMail, Brauundrauchshop
-
Deutschland: Erbslöh Geisenheim GmbH, Erbslöhstrasse 1, 65366 Geisenheim, Tel +49 6722 708-0, info@erbsloeh.com, Erbslöh Geisenheim Getränketechnologie (erbsloeh.com)
-
Österreich: Erbslöh Austria GmbH, St. Margarethner Straße 69 a, 7011 Siegendorf, Tel +43 2687 21190, info-austria@erbsloeh.com, (erbsloeh.com)
-
Belgien/Europa: Brouwland bv, Korspelsesteenweg 86, 3581 Beverlo, Tel +32 11 40 14 07, info@brouwland.com, Brouwland (Bier), Brouwland (Enzyme)
-
USA/weltweit: White Labs Inc., Europavertretung: Kirstinehøj 1, 2770 Kastrup Denmark, Tel +45 3161 5142, orderscph@whitelabs.com, WhiteLabs (Enzyme)
-
x
MUG
Mikrobrauerei
seit 2012
Für Edge+Chrome+Firefox auf Notebook, Personal Computer und iPad optimiert, für Smartphones ungeeignet
06.02.2026




