BRAU- und MESSTECHNIK
Brausystem, eingesetzte Messverfahren und weitere Techniken im Überblick
BRAU- und MESSTECHNIK
Brausystem, eingesetzte Messverfahren und weitere Techniken im Überblick
Stand: 31.01.2023
WASSER
Physikalisch-chemische
und mikrobiologische Untersuchungen
im Braulabor
PRAXIS
Brauwasseranalysen
Bierwürzeanalysen
+ Zusatzanalysen
Brauwasser:
Theoretische Grundlagen
Übersicht Untersuchungen
Inhaltsverzeichnis
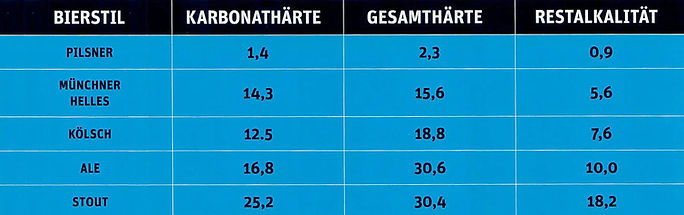
Abb. 1. Der Bierstil wird auch vom Wassertyp, insbesondere von der Restalkalität beeinflusst.
Härtegrade sind hier als deutsche Härtegrade (°dH) angegeben. In der Schweiz werden abweichend davon die französischen Härte-grade verwendet (Umrechnung: 1 °dH = 1.7848 °fH, 1 °fH = 0.56029 °dH. Umrechner).
1. WASSER: Körper des Bieres
1.1. Wasser - mengenmässig die Hauptmasse des Bieres
Die aussergewöhnlichen Eigenschaften von Wasser wie z.B. hoher Schmelz- und Siedepunkt, hohe Wärmekapazität, hohe Oberflächenspannung, herausragendes Lösungsmittel, ideales zelluläres Reaktionsmedium sowie die Aggregatszustände gasig - flüssig - fest sind bereits im Kapitel "Brauwasser" besprochen worden (siehe hier).
Wasser ist mit mindestens 90% mengenmässig der wichtigste Braustoff (Abb. 1) und für den gesamten Brauprozess von Bedeutung und mitentscheidend für den Charakter und die Qualität eines Bieres. Allerdings muss auch festgehalten werden, dass die früher so wichtige ortswasserabhängige Biertypo- logie wie Pilsener, Dortmunder, Münchner, Wiener oder Burton-on-Trent (England, Pale Ale) an Bedeutung verloren hat, wendet man dich heute fast identische Brauverfahren an und kann das Wasser entsprechend aufbereiten. Aber das Wasser aus dem glasklaren Alpengebirgsbach oder aus der St. Albinquelle, das nach durchschnittlich 30 Jahren und einem mindestens 1000 Meter tiefen, tiefen Weg aus der Bergquelle kristallklar hervor sprudelt, ist natürlich Teil des Marketing-Lifestyles, ohne den offenbar heutige Genussprodukte nicht mehr auskommen können ....
Als Brauwasser ("Guss") wird das zur Herstellung der Bierwürze benutzte Wasser bezeichnet. Daneben spielt Wasser auch eine
wichtige Rolle z.B. bei der Anzucht der Hefen, bei den Reinigungsverfahren und bei der Kalibrierung/Justierung gewisser Geräte
im Braulabor wie z.B. das Digital-Refraktometer oder des easyDens-Dichtemessgerätes. Die Wassergabe zum Maischen wird als
Hauptguss bezeichnet, während der Nachguss beim Abläutern zum Treberwaschen (Nachschwänzen zum "Aussüssen") benutzt
wird.
Trotzdem, die physikalisch-chemischen Eigenschaften des Brauwassers und die Qualität des eingesetzten Trinkwassers sind
nicht zu vernachlässigen. Dies zeigt sich auch daran, dass in der sehr empfehlenswerten Reihe der "Brewing Elements Series"
(Info) dem Wasser ein eigener Band gewidmet ist (Info), was allerdings angesichts des Umfangs (296 S.) und der nicht ganz
einfachen chemischen Materie (z.B. Alkalinität) nicht gerade für Heimbrauer eine Einladung zur vertieften Auseinandersetzung
mit Wasser darstellt.
Besonders bedeutungsvoll ist die Kenntnis und Beeinflussung des pH-Wertes (= Säuregrad wässriger Lösungen), beeinflusst er
doch z.B. die Aktivität der "Schlüsselakteure" der Bierherstellung während der Maische, nämlich die Enzyme, welche die Malz-
stärke in die Zuckereinheiten zerlegen.
1.2. Brauwasser - die entscheidenden Kenngrössen physikalisch-chemischer Natur
Um Brauwasser zu verstehen und, falls notwendig, auch aufbereiten zu können, sollte man 1. Wasseranalysen (z.B. des Wasser
versorgers) lesen und interpretieren können (Bsp. DKGF-Fontnas, Info), 2. ein geeignetes Wasserprofil für den gewünschten Bier-
stil ermitteln und 3. geeignete Aufbereitungsverfahren kennen und anwenden können. Dazu ist allerdings auch ein gewisses Mass
an chemisch-physikalischem Grundlagenwissen notwendig. Häufig aber ist nur eine geringe Modifikation notwendig.
Folgende Wassereigenschaften stehen im Fokus des Bierbrauers (* Schlüsselparameter):
1. Temperatur* - beeinflusst alle physiologisch-biochemischen Prozesse, insbesondere Enzyme (Temperaturoptimum)
und dadurch ganze Organismen wie Hefen --> zur Theorie Temperatur
2. pH-Wert* - Mass für den Säuregrad des Wassers bzw. einer wässrigen Lösung --> zur Theorie pH-Wert
3. Wasserhärte (Gesamthärte GH) - Summe aller Calcium- und Magnesiumverbindungen --> zur Theorie Wasserhärte
4. Karbonathärte KH (Säurekapazität, syn. Säurebindungsvermögen "SBV") - Ca2+ und Mg2+-Kationen (= positiv
geladene Ionen), die an die negativen Hydrogencarbonationen HCO3- (= Anionen) gebunden sind --> zur Theorie
5. Nichtkarbonathärte NKH - Mineralsäurehärte, Ca2+- und Mg2+-Ionen gebunden an andere Anionen wie Chloride Cl-
und Sulfate SO4 2- --> zur Theorie Nichtkarbonathärte
6. Calcium- und Magnesiumionen - Ca2+ Mg2+ Hauptplayer unter den Kationen, sowohl für Gesamthärte als auch
für die entscheidende Restalkalität inkl. pH-Wert entscheidend --> zur Theorie Calcium-/Magnesium-Härte
7. Restalkalität* - neben pH-Wert und Temperatur die Kardinalgrösse für das Brauwasser --> zur Theorie Restalkalität
8. Wasserinhaltsstoffe wie Alkaliionen Na+ und K+, Chlor/Chlorid Cl-, Sulfat SO4 2-, Nitrationen NO3-, Eisenionen
--> zur Theorie weitere brautechnisch wichtige Wasserinhaltsstoffe
Weitere interessante und aussagekräftige Wasserparameter sind
9. elektrische Leitfähigkeit --> zur Theorie Leitfähigkeit/TDS (Total Dissolved Solids)
10. gelöster Sauerstoffgehalt O2 (inkl. Vermeidung von O2-Eintrag) --> zur Theorie Gelöster Sauerstoff
Keine physikalisch-chemischen Wasserparameter, aber ebenfalls wichtig sind die
11. mikrobiologischen Kenngrössen - insbesondere die "Gesamtkeimzahl" ( = aerobe mesophile koloniebildende
Einheiten) --> zur Theorie Mikrobiologie des Brauwassers
Weitere wichtige bzw. wünschenswerte Analysen für das Braulabor:
12.1. Stärkenachweis --> zur Theorie Iodprobe (qualitativer Stärkenachweis beim Maischen)
12.2. IBU International Bitter Units --> zur Theorie International Bitter Units
12.3. SRM/EBC Farbstärke von Bier/Bierwürze --> zur Theorie Farbstärke EBC
Das minimale Grundwissen (Theorie) zum vertieften Verständnis der Wasser-Kenngrössen ist auf der Seite "Brauwasser"
(MUG-MIKROBRAUEREI > Brauwasser) zu finden (hier).
Abb. 2. DAS Wasserbuch für den ambitionierten Heimbrauer.
2. WASSERANALYSEN - lesen und interpretieren
2.1. Der Wasserversorger muss den Konsumenten mit Wasseranalysedaten versorgen
In der Schweiz gilt folgende Rechtsgrundlage: Verordnung EDI (Eidgenössisches Departement des Innern) über Trink-, Quell-
und Mineralwasser vom 23.11.2005, Stand 01.01.2014 (SR 817.022.102). Ausgangslage: Im Artikel 5 Information wird festge-
halten, dass die Trinkwasserverteiler mindestens einmal pro Jahr ihre Kunden umfassend über die Wasserqualität informieren
müssen. Dies wird je nach Gemeinde verschieden organisiert, häufig aber sind diese Informationen auf der Homepage einer
Gemeinde zu finden. Oder aber die dafür verantwortlichen Wasserversorger wie z.B. in der Gemeinde Wartau Kt. SG die zu-
ständigen Wasserkorporationen (z.B. die Wasserversorgungskorporation DKGF; diese publiziert jedes Jahr eine Zusammen-
fassung der Trinkwasseranalysen auf dem Web, z.B. die Jahresmittelwerte für 2018; anderes Bsp.: Bad Ragaz, Stadt Zürich).
Auskunft sollte jedes Wasseramt über die "chemischen Eckpfeiler" des Brauwassers geben können, nämlich mindestens
1. Gesamthärte, 2. Karbonat- und Nichtkarbonathärte, 3. den pH-Wert und evtl. 4. Massnahmen der Wasseraufbereitung
(Desinfektion-Behandlung mit Ozon- oder UV-Strahlung und Chlorierung) (Info, Video).
Info:
Schweiz: Wasserkompendium Trinkwasserdatenbank
Deutschland: Wie gut ist unser Trinkwasser (Video) Deutschland: Trinkwasserverordnung
Österreich: Infoportal Trinkwasser Trinkwasserdatenbank .
Abb. 3. Beurteilung von Wasseranalysen.
Ein Buch zur vertieften Beur-teilung von Wasseranalysen, für den Wasserfachmann oder den chemisch interessierten Heim-brauer.
2.2. Die wichtigsten Parameter einer offiziellen Wasseruntersuchung kurz interpretiert
2.2.1. Am Beispiel Trinkwasser interpretiert
Im Kanton St. Gallen umfasst die amtliche Wasseruntersuchung die in Abb. 3 gezeigten physikalisch-chemischen und mikrobiologischen Parameter (Grundlagerninfo dazu: gesetzliche Grundlage: hier; Wasseranalysen: Grundlage, Analysenspektrum).
In der folgenden Tabelle wird die allgemeine Bedeutung inkl. Beurteilung der Aussagekraft für das Brauwasser sowie die allgemeine Interpretation für die Verwendung als Trinkwasser kurz skizziert. Die Spalte "Interpretation für Trinkwasser" bezieht sich auf die in Abb. 3 enthaltenen Messwerte einer Untersuchung des DKGF-Trinkwassers.

Abb. 4. Beispiel einer amt-lichen Trinkwasserunter-suchung des MUG-Brau-wassers vom 27.04.2017
(ohne pH-Wert, wurde separat gemessen: 7.6).
Tab. 1. Wasseranalysen interpretiert am Bsp. einer Trinkwasseruntersuchung des Wasserversorgers DKGF (Info) vom 27.04.2017
3. WASSERANALYTIK - wichtige Nachweisverfahren für Brauwasser und Bierwürzen
3.1. Die Temperaturbestimmung
Theoretische Überlegungen und Informationen zur Bedeutung der Temperatur im gesamten Brauprozess sind unter MUG-MIKROBRAUEREI > Brauwasser zu finden (siehe hier).
Zusammenfassend kann festgehalten werden, dass die Temperatur einen ganz entscheidende Grösse für die aus dem Brauprozess resultierende Bierqualität darstellt. Die Temperatur beeinflusst insbesondere die Prozesse/Phasen der
-
Maischeprozesse (Aktivitäten der Maischenzyme [Proteasen, β-Amylasen, α-Amylasen, Phosphatasen]
-
Hauptgärung (unter- wie obergärige Fermentation)
-
Nachgärung (sekundäre Flaschengärung)
-
Konditionierung (Kaltlagerung, Reifung, Klärung).
-
Starterkulturen, Hefeanzuchten und Stammhaltung (Hefereinstammkulturen auf Schrägagar, Kryokon-
servierung).
6. Biergenuss (Lager- und Genusstemperatur).
Die Temperatur beeinflusst also sowohl biologisch-biochemische Prozesse (Stoffwechsel als Ganzes, einzelne
Enzyme als "Schrittmacher" des Stoffwechsels als auch chemisch-physikalische Vorgänge (Löslichkeiten von
Substanzen, Ausfällung von Substanzen wie Proteine, Klärung, Kalkausfällung u.a.). Die Messung der Tempe-
ratur und die Temperatursteuerung und Temperaturregelung sind daher zentrale Faktoren während des
gesamten Brauprozesses bis zum fertigen Bier.
Die detaillierten Anleitungen dazu befassen sich nur mit der Messung der Temperatur; die Steuerung/Regelung
ist unter "MUG-BRAUPROZESSE & BIERE > Mikrobiologisches Braulabor II > Braulabor 24: Wie überwacht und
regelt man den Gärprozess?" behandelt (siehe hier).
Genaues Vorgehen: PDF-Dokument "Temperaturbestimmung - Messgeräte und Vorgehen"
3.2. Die Bestimmung des pH-Werts (Säuregrad einer wässrigen Lösung)
Theoretische Überlegungen und grundlegende Informationen sowie erste Hinweise zur Bedeutung des pH-Wertes im gesamten Brauprozess sind unter MUG-MIKROBRAUEREI > Brauwasser zu finden (siehe hier). Wichtig sind auch die Hinweise zu Messungenauigkeiten hier.
Zusammenfassend kann festgehalten werden, dass neben der Temperatur der pH-Wert der
zweite entscheidende Parameter in verschiedenen Phasen des gesamten Brauprozesses ist:
Der pH-Wert spielt eine wichtige Rolle in allen Lebensprozessen, sowohl auf der Stufe von Zellen
(Hefezellen, Bakterien) als auch auf der Stufe von herausgelösten Stoffwechselvorgängen wie z.B.
Stärkeabbau in der Maische:
-
in Hefe-und Bakterien-Anzuchtlösungen: Hefen pH 5 - 6.5, Milchsäurebakterien (Lactobacillen)
schwach saurer Bereich (pH 5 - 6.5)
-
frisches Brauwasser: pH-Werte > 7.0 --> negativer Einfluss auf Enzymtätigkeiten und
geschmackliche Auswirkungen des Hopfens
-
ganz wichtig beim Maischeverfahren: stärkeabbauende Amylasen: pH 3.5 - 9, optimal bei
5.5-5.6 [Kunze, Technology Brewing and Malting, 1999], β-Amylase pH 5.2 (Info1, Info 2), allgemein
"Maischeenzyme": pH 5.2 - 5.4 (helle Biere), pH 5.4 - 5.6 (dunkle Biere) (Info), Maische allg.
Richtwert pH 5.0/5.2-5.6.
-
in Bierwürzen: Anstellwürze pH 5.1-5.2
-
in Gärlösungen:
- Gärwürze: während Gärung sinkt der pH-Wert sehr rasch (2. Tag: ca. pH 4.4, meist zwischen
pH 4.3 - 4.7 (bedingt durch CO2-Bildung und anderer Säuren organischer Natur)
- Hopfen: gärungsbedingte niedere pH-Werte verursachen neben anderen Faktoren die Aus-
scheidung der Hopfenharze und Gerbstoff-Eiweissverbindungen --> Verlust von 35-50% der
Bitterstoffe
-
Sedimentation der Hefen (Bruchbildung): bei einem pH-Wert < 5 unterstützen kolloide Stoffe wie hochmolekulare Eiweissstoffe und Gummistoffe des Malzes, die bei tieferem pH als 5 eine positive Ladung tragen und so mit den negativ geladenen Zellen das Zusammenkleben und Ausflocken der Hefen (primär Bruchhefen, begrenzt Staubhefen) begünstigen
-
Endprodukt Bier: in Lagertanks/Nachgärungsflaschen entstehendes Bier hat vorzugsweise einen pH-Wert
von 4.5 (manche Biersorten bis zu 3.5).
-
Wasserbehandlungen: Eisen-Entfernung mit Phosphorsäure H3PO4 auf pH 5.5-5.7; pH-Senkung durch Zugabe
von Milchsäure C3H6O3, Zugabe von Calciumsulfat (Gips, CaSO4) oder Calciumchlorid (CaCl2, ca. 1 Teelöffel),
Wasser enthärten durch CaO-Zugabe --> pH-Senkung, Carbonate wie Natriumbicarbonat (Backsoda, Natrium-
hydrogencarbonat, NaHCO3) --> pH-Erhöhung.
Wichtig: Messfehler mit elektronischen pH-Metern
Biologisch - Grundsätzlich gilt, dass jeder enzymgesteuerte Prozess sich nur in einem relativ engen pH-Bereich optimal
abläuft, da die Enzymaktivitäten stark pH-abhängig sind (Abb. 7).
Messtechnisch - Die Temperatur hat einen nicht unerheblichen Einfluss auf die Eigenschaften von pH-Elektroden, Puffer-
und Messlösungen.
Fachliche Exkursion: Die pH-Skala wird in wässrigen Medien mit 0 - 14 angegeben, da das Ionenprodukt des Wassers in stark verdünnten
Lösungen bei der Referenztemperatur 25 °C recht genau 10^-14 [mol/L]^2 beträgt. Das Ionenprodukt ändert sich jedoch mit der Temperatur
und beträgt bei 100 °C etwa 10^-12 [mol/L]^2; damit ändert sich die Neutralität mit [H+] = [OH-] von pH = 7.0 bei 25 °C auf pH = 6.15 bei 100 °C.
Gute elektronische pH-Meter weisen eine sog. Temperaturkompensation auf (= ACT-pH-Meter, Automatische Temperatur Kompensation).
Diese Temperaturkompensation berücksichtigt aber lediglich die Änderung der theoretischen Steilheit (= Temp.abhängigkeit des Nernst-Faktors
zur Beschreibung der Spannung der pH-Messkette, cf. Info Laborpraxis > S. 76) bei Temperaturänderungen.
Wichtig: Kalibriert man das pH-Messgerät bei einer bestimmten Temperatur und misst bei einer anderen Temperatur als der Kalibriertemperatur,
so passt die Temperaturkompensation die Steilheit entsprechend der Änderung des Nernst-Faktors an. Bei Messungen mit stark voneinander
abweichenden Temperaturen muss die Messkette für jede Messtemperatur mit Puffern gleicher Temperatur kalibriert werden.
Für die Heimbraupraxis übersetzt heisst das:
1. Elektrochemische Reaktion der pH-Sonde: Je grösser der Unterschied in der Temperatur zwischen Kalibrierung und Messung ist (z.B. Kalibrierung
bei Zimmertemperatur, Messung in der heissen Maische bis Bierwürze bei > 50 °C bis Siedepunkt), umso grösser können die Messabweichungen
werden.
2. Die chemische Aktivität der Würze ist ebenfalls stark temperaturabhängig und ändert die pH-Verhältnisse. Beide Faktoren zusammen können eine pH-Abweichung von bis zu 0.3 pH-Einheiten in der heissen Würze bewirken.
3. Praktische Konsequenzen:
-
Kalibrierung (Eichung): pH-Werte immer bei einer identischen Standard-Referenztemperatur kalibrieren (zwischen 20 - 25 °C, optimal bei 25 °C).
-
Eichpuffer: Kalibrierung mit 2 Eichpuffern immer in der Nähe des zu messenden pH-Wertes, z.B. Maische - erwarteter pH-Wert um 5.2-5.8: mit Puffern pH 4.0 und 7.0 kalibrieren
-
pH-Messung: Sowohl Brauwasser, Maische, Würze als auch Bier werden ohne anderslautende Angaben immer bei der Referenztemperatur 25 °C messen.
-
pH-Sonde: Je häufiger bei höheren Temperaturen (z.B. direkt in der Maische) gemessen wird, desto kürzer ist die Lebensdauer der pH-Sonde. Angaben des Hersteller betr. Lebensdauer beachten.
Ausführliche Informationsquellen: Info 1 (Metrohm Toledo: Praxisbezogene Anleitung zur Messung von pH); Info 2 (Labor Praxis: pH Tipps & Tricks); Info 3 (Technisches Messen: Industrielle pH-Messung - Beiträge der Temperatur zur Messunsicherheit).
Messprinzip: Der pH-Wert kann sehr einfach, aber relativ grob durch Farbstoffindikatoren ermittelt werden. Wesentlich genauer wird die Bestimmung potentiometrisch mit Hilfe einer Glaselektrode (= elektronische pH-Meter). Siehe auch hier.
Genaues Vorgehen: PDF-Dokument "Bestimmung pH-Wert mit Indikatoren und pH-Messgeräten (Glaselektroden)"
Abb. 6. Temperatur bestimmen mit klassischen Thermometern und elektro-nischen Geräten.
Abb. 7. Abhängigkeit der Enzymaktivität vom pH-Wert.
Beispiel: stärkeabbauende Amylase. Jedes Enzym hat sein eigenes pH-Optimum, cf. Tab. hier).
Info: allgemein spez. Brautechnik
Abb. 8. pH-Werte bestimmen - klassisch mit Farbindikatoren und elektronisch mit Digital-pH-Metern.

2.2.2. Am Beispiel Brauwasser interpretiert
Wasser ist nicht einfach H2O, sondern ist eher als Lösung von zahlreichen Stoffen zu verstehen (vgl. z.B. mögliche Stoffnachweise in einer umfassenden Wasseranalyse hier oder amtlich angebotener Wasseranalysen am Bsp. des Kantons St. Gallen hier).
Wasserchemische Untersuchungen wie z.B. unter 8. Wasserinhaltsstoffe geben zwar Auskunft über Art und Menge einzelner Ionen und anderer Stoffe im Wasser, aber interessant sind primär die für das Brauen wirklich wirksamen Inhaltsstoffe - und das sind vor allem gewisse "Salze", nämlich Calcium- und Magnesiumsalze. Insgesamt sind nur etwa sechs Ionen, von Interesse, davon sind wiederum nur vier* zu kontrollieren.
Einen knappen Überblick über die wirklich relevanten Ionen gibt Abb. 5.
Folgende Informationen über die sechs wichtigen Ionen sind braurelevamt:
-
*Calcium Ca2+:
- optimale Konzentration im Bereich 50-150 ppm; empfehlenswertes Minimum:
50 ppm
- Ca2+ macht Wasser "hart", zusammen mit Mg2+ --> cf. 3.3. Wasserhärte
- Ca2+ ist aciditätsfördernd: reagiert mit Phosphaten im Malz unter Protonen [H+]-
Freisetzung: 3 Ca2+ + 2 HPO4 2- <--> Ca3(PO4)2↓ + 2 H+, pH-Wert sinkt
- Ca2+ ist zwar kein wichtiges Nährelement für die Hefen, ist aber wichtig für die
Flokkulation von Hefen, für einzelne Enzymreaktionen und für Proteine
(stabilisiert alpha-Amylase und steigert dadurch deren Temperaturtoleranz in
der Maische)
- bei identischen Ca2+- und HCO3- -Mengen kann diese sog. "temporäre Wasser-
härte" (= Carbonathärte) durch Erhitzen vermindert werden
- die "bleibende" Härte (= Nichtcarbonathärte) rührt von der durch Kochen nicht
reduzierbaren Calcium- und Magnesiumionen
- Wasserhärte ist weder böse noch gut - dies ist abhängig vom jeweiligen Bierstil:
z.B. ist für dunkle Biere die temporäre Wasserhärte günstig, während bleibende
Härte für das Brauen von Pale Ales günstig ist
- Tipp: für den gewünschten Bierstil den geeigneten Calciumgehalt bzw. Wasserhärte
evaluieren: cf. "John Palmer Water Calculator" hier. Ebenfalls hilfreich Greg Noonans
"Water witch".
-
*Bicarbonat HCO3-:
- optimale Konzentration von Carbonat CO* 2- und Bicarbonat HCO*- liegt im
Bereich 0-250 ppm (als "Gesamtalkalität": im Bereich 0-200 ppm)
- je nach Biertyp: 0-50 ppm für Pale-Malz-Biere, 50-120 ppm für Amber-Malzbiere
und 150-250 ppm für dunkle Malzbiere
- "Säurevernichter": Bicarbonat-Ionen (und auch Carbonat-Ionen CO3 2-)
beeinflussen den pH-Wert durch Neutralisierung von Säuren: HCO3- + H+ -->
H2CO3 --> H2O + CO2↑ (--> erhöht pH-Wert; ein hoher Maische-pH kann in einen
schlechten Extraktgehalt resultieren, die Würze trüben und Tannine auslaugen)
-
*Chlorid Cl-:
- optimale Konzentration im Bereich 0-150/250 ppm
- Chlorid kann ähnlich wie Natrium im unteren Konzentrationsbereich den Malz-
charakter betonen sowie Körper und Süsse vermitteln
- bei zu hoher Konzentration kann Chlorid zu Fehlaromen führen
-
*Sulfat SO4 2-:
- optimale Konzentration im Bereich 0-150 ppm (nach gewissen Autoren sogar im Bereich 50-350 ppm)
- Sulfat akzentuiert die Bitterkeit des Hopfens, kann aber ab > 400 ppm auch zu kratziger Bitterkeit führen
-
Natrium Na+:
- optimale Konzentration im Bereich 0-150 ppm
- Natrium akzentuiert die Geschmacksausbildung von Malz
- > 300 ppm kann metallischen Geschmack verursachen
- Natriumhydrogenkarbonat NaHCO3 ist besonders aciditätsvernichtend
- Vorsicht bei Enthärtungsanlagen (Info): es werden 1 mol Ca2+ und Mg2+ gegen 2 mol Na+ getauscht
-
Magnesium Mg2+:
- optimale Konzentration im Bereich 10-30 ppm, empfehlenswertes Minimum 5 ppm
- trägt zusammen mit Ca2+ zur Wasserhärte bei und reagiert ähnlich wie Calcium aciditätsfördernd, wenn auch deutlich schwächer
- Mg2+ ist ein Nährmineral für die Hefe, wird i.d.R. durch Malz in ausreichender Menge geliefert
- Mg-Konzentration sollte sich eher im unteren Bereich bewegen (0-30 mg Mg/L, maximal 50 mg/L), da es zu Fehlaromen beitragen kann (Beigeschmack,
bitter, metallisch) (Info)
- Mg kann sich in Lebensmitteln und Getränken mit einem abführenden Effekt bemerkbar machen
Abb. 5. Die wichtigsten Ionen im Brauwasser.
Kurzcharakterisierung und Chemikalien zum Wasserdesign.

Abb. 10. Das exact iDip-Fotometer-Messsystem ist sehr vielseitig und erfasst alle wichtigen Wasser-parameter, so natürlich auch die Wasserhärten.
3.3. Die Bestimmung der Wasserhärte GH (Gesamthärte)
Weitergehende theoretische Überlegungen und zusätzliche grundlegende Informationen
sowie Hinweise zur Bedeutung der Wasserhärte für das Brauwasser und Bier sind unter
"MUG-MIKROBRAUEREI > Brauwasser" zu finden (siehe hier).
Die Gesamthärte GH gibt die Summe der Konzentrationen der Kationen von Erdalkali-
metallen in Wasser an. Entscheidend sind dabei vor allem die Summe der Härtebildner
Calcium und Magnesium. Die Gesamthärte des Wassers umfasst alle Ca- und Mg-
Verbindungen (Calciumhärte + Magnesiumhärte). Der wichtigste Inhaltsstoff im Wasser
sowohl für die Gesamtwasserhärte als auch für die Karbonathärte (vgl. 3.4.) ist Kalk, der
in einem komplexen pH-abhängigen Wechselspiel mit dem gasigen CO2 und dem daraus
sich bildenden Hydrogenkarbonat HCO3- steht (Abb. 9).
Bedeutung der Gesamthärte für den Brauprozess:
Die Gesamthärte des Wassers kann im Gegensatz zur Karbonathärte positive Wirkungen
beim Brauen entfalten, da die Härtebildner Calcium und Magnesium durch Reaktionen
mit Maischebestandteilen Säure freisetzen und dadurch einen Teil der unerwünschten
Karbonathärte "neutralisieren" (vgl. 3.4. Die Bestimmung der Karbonathärte).
Die Bestimmung der Gesamthärte ist primär aber zur Berechnung der wichtigen
Restalkalität (vgl. 3.7 Restalkalität) notwendig.
Messprinzip: Kolorimetrischer Nachweis der Gesamthärte (als CaCO3) mit einem Fotometer im tiefen Konzentrationsbereich (1-80 ppm) und hohen Konzentrationsbereich (90-600 ppm).
Info (cf. abstract).
Hinweis: Weitere Testverfahren für verschiedene Konzentrationsbereiche und verschiedene Verfahren sind
ausführlicher im theoretischen Teil behandelt (cf. hier).
Die Gesamthärte kann auch mittels einer sog. Titration (Info) erfasst werden. Calcium- und
Magnesium-Ionen bilden mit einem Indikator einen roten Komplex. Bei der Titration mit Titriplex III
(Ethylendinitrilotetraessigsäure Dinatriumsalz) wird aus diesem Komplex der Indikator freigesetzt,
wobei ein Farbumschlag nach Grün erfolgt (Info, Kurzanleitung). Noch einfacher, aber weniger genau
geht es mit den Teststäbchen ("Gesamthärte-Test", cf. hier).
Genaues Vorgehen: PDF-Dokument "Bestimmung der Wasser-Gesamthärte. Messgeräte und Vorgehen"
Abb. 9. Die Calciumverbindung Kalk CaCO3 und das gasige Kohlenstoffdioxid CO2 bilden ein komplexes 4-stufiges Gleich-gewicht im Wasser, das zudem noch vom pH abhängig ist.
Die Gesamthärte wird neben Calciumverbindungen auch noch von den weiteren Erdalkalimetallen bestimmt, primär von Magnesium.
3.4. Die Bestimmung der Karbonathärte KH (temporäre Härte, vorübergehende Härte, Säurebindungsvermögen SBV)
Weitergehende theoretische Überlegungen und zusätzliche grundlegende Informationen sowie Hinweise zur Bedeutung der Karbonathärte für das Brauwasser und Bier sind unter "MUG-MIKROBRAUEREI > Brauwasser" zu finden (siehe hier).
Was ist Karbonathärte?
Die Karbonathärte KH (auch Carbonathärte, vorübergehende Härte, temporäre Härte, nichtpermante Härte, Alkalität, Alkalinität, Gesamtalkalinität, Basizität, engl. Total Alkalinity TA) ist bedingt durch die Bicarbonate des Calciums und Magnesiums. Sie umfasst alle Ca- und Mg-Verbindungen mit Carbonaten CO3 2- und Hydrogencarbonaten HCO3- (CaCO3, Ca(HCO3)2, MgCO3, Mg(HCO3)2).
Sie wurde auch als vorübergehende bzw. temporäre Härte bezeichnet, da beim Kochen des Wassers die löslichen Erdalkali-Hydrogenkarbonate unter Abspaltung von CO2 in mehr oder weniger lösliche Karbonate umgewandelt werden:
Summarisch wird es häufig wie folgt dargestellt: Ca2+ + Mg2+ + 4 HCO3- --> CaCO3↓ + MgCO3↓ + 2 H2O + 2 CO2.
Eine genauere Betrachtung ergibt:
Ca-Ausfällung: : Calcium Ca(HCO3)2 <--> Ca2+ + 2 HCO3- <--> CaCO3*↓ (Ausfällung: Kesselstein) + CO2↑ (Entweichung) + H2O *: nur ein kleiner Restanteil = ca. 0.8 °dH = 1.4 °fH = 14 ppm = 14 mg CaCO3/1 L H2O bleiben gelöst
Mg-Ausfällung: Mg(HCO3)2) --> MgCO3 (aber viel löslicher als CaCO3) + CO2↑ (Entweichung) + H2O --> diese Reaktion spielt sich infolge der viel besseren Löslichkeit von MgCO3 (110 ppm = 110 mg/L) aber kaum eine Rolle !! Das entstehende Magnesiumkarbonat kann somit auch durch längeres Kochen kaum ausgeschieden werden.
NaHCO3 Natriumhydrogenkarbonat und Natriumkarbonat (Soda) Na2CO3/ Na2CO3.10H2O können durch Kochen in ihrer Konzentration nicht verringert werden.
Fazit: Beim Erhitzen wird das Wasser primär durch die Calciumausfällung als Kalkstein "weicher".
Die Karbonathärte KH ist meist etwas niedriger als die Gesamthärte GH: KH < GH. In Wasser, das besonders reich an CO3 2- und HCO3- -Ionen ist und die Gleichsetzung ("äquivalent") Konzentration (Erdalkali-Ionen) ≡ Konzentration (CO3 2-, HCO3-, OH-) nicht mehr zutrifft, wird als Karbonathärte die Gesamthärte angegeben: KH ≡ GH (vgl. hier).
Bedeutung der Karbonathärte für den Brauprozess:
Kalkstein/Kesselstein: Die löslichen Karbonate sind sehr instabil und gehen dadurch beim Erhitzen bereits oberhalb von etwa 60 °C in unlösliche Calcium-Karbonatverbindungen über --> Bildung von Kalkstein, Ablagerung als Kesselstein. Dies ist bei Geräten natürlich ungünstig (Bsp. Pfannen, Boiler, Sudkessel).
Abbau von Säure ("aciditätsvernichtend", "Säurevernichter", "Säurebindend"), pH-Wert erhöhend: Bei der Einschätzung der Eignung des Brauwassers für den gewünschten Biertyp (z.B. Pilsner: Gesamthärte 2.3 °dH, 4.1 °fH , 41.2 ppm, Karbonathärte 1.4 °dH, 2.5 °fH , 25 ppm; Wiener: Gesamthärte 38.6 °dH, 69.1 °fH , 691 ppm, Karbonathärte 30.9 °dH, 55.3 °fH , 553 ppm) ist die Karbonathärte von zentraler Bedeutung, denn sie ist durch die Hydrogenkarbonat-Ionen HCO3- "säurevernichtend". HCO3- fängt die H+-Ionen einfach ab: HCO3- + H+ bzw. H3O+ (Proton bzw. Hydroniumion , "Säureteilchen", cf. hier) --> H2O bzw. 2 H2O + CO2↑.
Die Hydrogenkarbonat-Ionen entziehen beim Erhitzen oder allgemein bei chemischen Reaktionen die H+-Ionen und damit steigt der pH-Wert in Richtung alkalisch/basisch, oder anders formuliert: die Alkalität steigt. Dies hat weitreichende Auswirkungen auf den gesamten Brauprozess, z.B. stärkere Auslaugung von Malzgerbstoffen --> derber Biergeschmack, Intensivierung der Bierfarbe; Beeinträchtigung der Maischeenzymaktivitäten (Wirkungsoptimum der beta-Amylasen bei pH 5.4 wird nicht erreicht --> schlechter Vergärungsgrad); Würzekochen resultiert in verstärkter Lösung von Hopfenbitterstoffen --> kratzige, unangenehme und nachhängende Bittere im trinkfertigen Bier, besonders bei hellen, stärker gehopften Bieren.
Messprinzip: Es gibt verschiedene Verfahren zur Bestimmung der Karbonathärte.
Eine gebräuchliche Methode ist die massanalytische Bestimmung des Säureverbrauchs gegen verschiedene Säure-/Basen-
Indikatoren, z.B. Phenolphthalein und Mischindikator pH 4.3 (Mischindikator nach Cooper - Methylrot/ Bromkresolgrün
[Info]), oder Mischindikator pH 4.5 nach Mortimer (Rezeptur) oder Mischindikator aus Methylorange und Methylenblau B.
Bei diesem Verfahren wird die Karbonathärte mit Salzsäure titriert, der Indikator von Blau nach Rot umschlägt (100 mL des
Wassers mit Salzsäure HCl (c = 0.1 mol/L) bis zum pH-Wert 4.3 titrieren. Bei dieser Titration werden alle in der Wasserprobe vor-
handenen Hydrogenkarbonat- und Karbonat-Ionen erfasst bzw. die diesen Ionen äquivalenten Mengen an Calcium- und Magnesium-
Ionen (Info).
Variation: titrimetrische Bestimmung mit Säure gegen Phenolphthalein und Methylorange.
Hinweis: Weitere Testverfahren für verschiedene Konzentrationsbereiche und verschiedene Verfahren sind ausführlicher im theo-
retischen Teil behandelt (cf. hier).
Noch einfacher geht es mit den Teststäbchen ("Carbonathärte-Test"), cf. hier).
Siehe auch Messprinzip "Säurekapazität bzw. Säurebindungsvermögen" (hier). Die Karbonathärte errechnet sich dann aus der
Säurekapazität multipliziert mit 2.8.
Genaues Vorgehen eines ausgewählten Verfahrens: PDF-Dokument "Bestimmung der Karbonathärte KH"
Theorie Karbonathärte Messgerät
Abb. 11. Die Bestimmung der Karbonathärte kann mit fix-fertigen Testbestecken oder
einer einfachen Titrationsvor-richtung erfolgen.
3.5. Die Bestimmung der Nichtkarbonathärte NKH (permanente Härte, bleibende Härte, Sulfathärte, Mineralsäurehärte)
Weitergehende theoretische Überlegungen und zusätzliche grundlegende Informationen sowie Hinweise zur Bedeutung der Nichtkarbonathärte für das Brauwasser und Bier sind unter "MUG-MIKROBRAUEREI > Brauwasser" zu finden (siehe hier).
Was ist Nichtkarbonathärte?
Die Nichtkarbonathärte als permanente Härte (oder Resthärte, auch Sulfat- oder Gipshärte, weil ein Teil der Härte durch diese Salze gebildet wird) umfasst die Calcium- und Magnesiumsulfate und ebenso die Chlorid- und Nitratsalze, z.T. auch Silicate oder Phosphate, die sich im Gegensatz zu der Karbonathärte auch beim Kochen nicht verändern (Bsp.: Sulfate SO4 2- Calciumsulfat CaSO4, Magnesiumsulfat (Bittersalz) MgSO4; Chloride Cl-: Calciumchlorid CaCl2, Magnesiumchlorid MgCl2; Nitrate NO3-: Calciumnitrat Ca(NO3)2, Magnesiumnitrat Mg(NO3)2). In der Regel entsteht die NKH zum grössten Teil aus der Auflösung von Gips (Calciumsulfat CaSO4), was für einen hohen Sulfatgehalt sorgt, daher auch der Begriff "Sulfathärte“.
Bedeutung der Nichtkarbonathärte für den Hauptbiertyp:
Die Nichtkarbonathärte NKH ist bei den 4 Haupttypen München, Pilsen, Dortmund und Pilsen verschieden ausgeprägt:
München KH NKH 14.2 0.6 °dH, 21.2 1.1 °fH , 254 10.7 ppm // Pilsen GH NKH 1.6 0.3 °dH, 2.9 0.5 °fH , 286 5.4 ppm // Dortmund GH NKH 41.3 24.5 °dH, 73.9 43.9 °fH , 739 439 ppm // Wien GH NKH 38.6 7.7 °dH, 69.1 13.8 °fH , 691 138 ppm . Das Verhältnis der Karbonat- zur Nichtkarbonathärte ist deutlich verschieden (München 14.2 : 0.6 = 18.7, Pilsen 1.3 : 0.3 = 3.3, Dortmund 16.8 : 24.5 = 0.7, Wien 30.9 : 7.7 = 4.0).
Weitere Brauwasserdaten bekannter Brauorte: Düsseldorf (Alt Bier) KH NKH 10.0 5.6 °dH, , Dublin (Stout, Porter) KH NKH 25.2 5.2 °dH, Burton-on-Trent (IPA, Ale) KH NKH 16.8 13.8 °dH.
Der NKH-Anteil ist an der Gesamthärte meistens kleiner als die Gesamthärte; zudem beeinträchtigen die mineralsauren Salze den Maischprozess kaum --> daher ist die NKH für den Brauprozess meist von geringerer Bedeutung.
Messprinzip: Die NKH wird rechnerisch erfasst aus den beiden kolorimetrischen Messungen der
Gesamthärte GH und der Karbonathärte KH: Nichtkarbonathärte = Gesamthärte - Karbonathärte,
bzw. NKH = GH - KH.
-
Bestimmung der Gesamthärte: cf. Kap. 2.4. (Theorie und knapper Methodenbeschrieb hier) sowie
Seite "Physikalisch-chemisches Braulabor" hier, Methode hier.
2. Bestimmung der Karbonathärte: cf. Kap. 2.5. (Theorie und knapper Methodenbeschrieb hier) sowie
Seite "Physikalisch-chemisches Braulabor" hier, Methode hier.
3. Berechnung der NKH:
Nichtkarbonathärte NKH [°dH] = Gesamthärte GH [°dH] - Karbonathärte KH [°dH].
Hier geht es direkt zur PDF-Anleitung "Bestimmung der Nichtkarbonathärte"
Abb. 12. Bestimmung Nichtkarbonathärte.
Die Bestimmung der Nichtkarbonathärte NKH erfolgt rechnerisch, wenn die Resultate der Gesamtwasser-härte und der Karbonathärte vorliegen.
3.6. Die Bestimmung der Calcium- und Magnesiumionen
Weitergehende theoretische Überlegungen und zusätzliche grundlegende Informationen sowie Hinweise zur Bedeutung der Calcium- und Magnesiumhärte für den Brauprozess sind unter "MUG-MIKROBRAUEREI > Brauwasser" zu finden (siehe hier).
Was ist Calciumhärte und Magnesiumhärte?
Das Calcium ist der wichtigste Anteil an der Nichtkarbonathärte bzw. permanten Härte. Calcium ist an allen wesentlichen Aspekten der Brauwasserchemie beteiligt: der Gesamthärte, der Karbonathärte, der Nichtkarbonathärte und der Restalkalität. Als Calciumhärte wird die Summe der Calciumionen im Brauwasser bezeichnet.
Magnesium ist rein chemisch gesehen dem Calcium sehr ähnlich, aber die Auswirkungen sind konzentrations- und chemiebedingt schwächer. Als Magnesiumhärte wird die Summe der Calciumionen im Brauwasser bezeichnet.
Bedeutung der Calcium- und Magnesiumhärte für den Brauprozess:
Senkt den pH der Maische (aciditätsfördernd, pH-Wert senkend) und begünstigt dadurch enzymatische Vorgänge. Wichtiger Hefenährstoff und begünstigt auch die Klärung des Bieres (Ausfällung des Eiweisses bei der Bruchbildung). Werte deutlich über 200 mg/L können einen mineralischen Beigeschmack haben, darunter gilt Calcium als geschmacksneutral. Magnesium ist nur etwa halb so wirkungsvoll wie Calcium und ein sehr bedeutender Hefenährstoff.
Das wichtigste aber sind die Werte der Ca- und Mg-Härte zur Berechnung der Schlüsselgrösse der Restalkalität, zusammen mit der Nichtkarbonathärte.
Messprinzip Calciumhärte:
-
Fotometrische Nachweismethode mit “eXact iDip Smart Photometer System” ist eine sehr einfache,
elegante fotometrische Methode: exact iDip Water Testing System, Fotometer (Info).
Calciumnachweis: siehe hier.
-
Macherey-Nagel Visocolor ECO Calcium-Test, 931 012, Info. Die Bestimmung der Calciumhärte
erfolgt mittels einer komplexometrischen Titration in stark alkalischer Lösung (Natriumhyroxid
NaOH: pH > 12) nach Ausfällung der Magnesiumsalze. Messbereich: 1 Tropfen = 5 mg/L Ca2+.
-
Merck MColortest Calcium, 1.11110.0001, Info. Calcium-Ionen bilden mit einem Indikator eine
rotviolette Komplexverbindung. Aus dieser wird beim Titrieren mit einer Lösung von Ethylen-
dinitrilotetraessigsäure Dinatriumsalz-Dihydrat (Titriplex® III) der Indikator freigesetzt. Am End-
punkt der Titration erfolgt ein Farbumschlag nach Blauviolett. Die Calcium-Konzentration ergibt
sich aus dem Verbrauch an Titrierlösung. Messbereich: 2 - 200 mg/L Ca2+, Abstufung der Titrier-
pipette 2 mg/l Ca2+.
Messprinzip Magnesiumhärte:
Bei zusätzlicher Bestimmung der Gesamthärte kann rechnerisch der Magnesium-Gehalt ermittelt werden.
Ermittlung des Magnesium-Gehalts: Mg-Gehalt [mg/l] = Gesamthärte [°d] x 7.15 - Ca-Gehalt [mg/L].
Hier geht es direkt zur PDF-Anleitung "Bestimmung der Calcium- und Magnesiumhärte"
Theorie Calcium- und Magnesiumhärte.
Abb. 13. Calcium-/Magnesiumhärte.
Die Bestimmung der Calcium härte erfolgt experimentell und die Bestimmung der Mg-Härte dann zusätzlich aus der Gesamthärte rechnerisch.
3.7. Die Bestimmung der Restalkalität
Weitergehende theoretische Überlegungen und zusätzliche grundlegende Informationen sowie Hinweise zur Bedeutung der Restalkalität für den Brauprozess sind unter "MUG-MIKROBRAUEREI > Brauwasser" zu finden (siehe hier). Siehe auch hier. Info.
Um den Einfluss eines Brauwassers auf die entscheidendsten Vorgänge in der Maischephase, in der ja die Malzstärke zu vergärbaren und nicht vergärbaren Zuckereinheiten wie Maltose und Dextrine enzymatisch abgebaut wird sowie weitere wichtige enzymgesteuerte Vorgänge ablaufen (z.B. Eiweissabbau zu Aminosäuren) zu beurteilen, spezifisch seine Einwirkung auf den Schlüsselparameter pH-Wert, wurde der Begriff der Restalkalität eingeführt. Diese wichtige Kennzahl beschreibt, wieviel von der (unerwünschten) säurevernichtenden Wirkung der Karbonathärte (cf. Kap. 3.4 hier) unter Berücksichtigung der übrigen chemischen Faktoren übrig bleibt.
Das Konzept der Restalkalität beschreibt also die Wechselwirkung zwischen der Wasser-Gesamthärte GH, der Karbonathärte KH bzw. Alkalinität sowie der pH-abhängigen Karbonatlöslichkeit als H2CO3 (= "reine Kohlensäure", pH 1-6), Hydrogenkarbonat HCO3- (pH-Bereich 6-10) und Karbonat CO3 2- (pH-Bereich 10-13) (Info > Abb. 2). Diese Pufferwirkung (Puffer: abfedernde Wirkung einer Säurezugabe bzw. Säurefreisetzung) [Info]) zwischen der säurevernichtenden HCO3--Wirkung und der säurefördernden Ca2+ und Mg2+ -Wirkung wird mit den Daten aus 1. der Wasser-Gesamthärte GH, 2. der Karbonathärte KH und 3. der Calciumhärte berechnet. Ganz vereinfacht lässt sich anschaulich sagen, dass die Restalkalität die Fähigkeit des Brauwassers ist, Säuren zu neutralisieren. Anders formuliert: Restalkalität ist nicht kompensierte Alkalität.
Die wichtige Aussagekraft der Restalkalität für den Brauer ist: "Was bleibt je nach Ca/Mg-Konzentration und der Karbonatkonzentration von der säurevernichtenden Wirkung der Karbonathärte übrig?"
Messprinzip: Die Bestimmung der Restalkalität RA ist ein indirektes rechnerisches Verfahren, nachdem zunächst experimentell die entscheidenden chemischen Parameter der Karbonathärte, Calciumhärte und Magnesiumhärte - und diese wiederum rechnerisch über die Gesamthärte und Calciumhärte - erfasst wurden.
Daraus ergibt sich das folgende Vorgehen: 1. Bestimmung der chemischen Grundlagen (1.-3.), 2. Berechnung der RA
1. Experimentelle Bestimmung der Karbonathärte:
cf. Kap. 3.4. Die Bestimmung der Karbonathärte KH (temporäre Härte, vorübergehende Härte, Säurebindungsvermögen SBV) --> cf. hier
2. Experimentelle Bestimmung der Calciumhärte
cf. Kap. 3.6. Die Bestimmung der Calcium- und Magnesiumionen --> cf. hier
3. Experimentelle Bestimmung der Gesamthärte:
cf. Kap. 3.3. Die Bestimmung der Wasserhärte GH (Gesamthärte) --> cf. hier
4. Rechnerische Bestimmung der Magnesiumhärte:
cf. Kap. 3.6. Die Bestimmung der Calcium- und Magnesiumionen --> cf. hier
Es ergeben sich die folgenden Berechnungsformeln für die Restalkalität RA: --> Umrechner verschiedener Härteskalen hier!
-
Restalkalität RA [°dH] = Karbonathärte KH [°dH] - (Calciumhärte [°dH]/3.5) - (Magnesiumhärte [°dH]/7)
bzw. 0,14 °dH = 1 mg/L Ca und 0,23 °dH = 1 mg/L Mg
-
Restalkalität RA [°dH] = Karbonathärte KH [°dH] - Calciumkonzentration [mg/L]/25.03 - Magnesiumkonz. [mg/L]/30.4
-
Restalkalität RA [°dH] = (Säurekapazität [mmol/L] x 2.8) - (Calciumkonzentration [mg/L]/25.03) - (Magnesiumkonz. [mg/L]/30.4)
-
Restalkalität RA [ppm CaCO3] = 0.83 x HCO3- -Konzentration [ppm] - (0.71 x Calciumkonzentration [ppm]) - (0.59 x Magnesiumkonz. [ppm])
Einfache Abschätzung der Restalkalität:
Überschlägig kann man die RA, z.B. bei Unkenntnis der Calcium- bzw. Magnesiumkonzentration, mit folgender Faustformel berechnen:
-
Restalkalität RA [°dH] = Karbonathärte KH [°dH] - (Gesamthärte GH [°dH]/3.5 oder 4).
Hier geht es direkt zur PDF-Anleitung "Bestimmung der Restalkalität"
Abb. 14. Schlüsselparameter Restalkalität.
Mit den selbst ermittelten bzw. vom Wasserversorger erhaltenen wasser-analytischen Daten geht es zur Berechnung der Restalkalität.
Dazu gibt es Rechenprogramme auf dem Netz - einige werden hier vorgestellt und die damit erhaltenen Resultate miteinander verglichen. [Quelle]
3.8. Die Bestimmung weiterer Wasserinhaltsstoffe (Natrium, Chlorid, Kalium, Sulfat, Nitrat, Eisen, Kupfer, Zink)
Weitergehende theoretische Überlegungen und zusätzliche grundlegende Informationen sowie Hinweise zur Bedeutung weiterer Wasserinhaltsstoffe für den Brauprozess sind unter "MUG-MIKROBRAUEREI > Brauwasser" unter "2.9. Kenngrösse 8: Weitere Wasserinhaltsstoffe" zu finden (siehe hier).
Zu den weiteren wichtigen gelösten Stoffen im Wasser, die einen Einfluss auf Brauprozesse haben können, sind folgende Ionen:
-
Natrium Na+
-
Chlorid Cl-
-
Kalium K+
-
Sulfat SO4 2-
-
Nitrat NO3-
-
Eisen Fe2+/Fe3+
-
Kupfer Cu2+
-
Zink Zn2+
Ihre wichtigste Bedeutung in brautechnischer Hinsicht sei kurz zusammen gefasst: iK idealer Konzentrationsbereich/ mK maximale Konzentration
-
Natrium: 10-70 mg/L - 100 mg/L; sind für den Stoffwechsel der Hefe wichtig; mit hohen Chlorid [Cl-] -Konzerntrationen salziges Fehlaroma
-
Chlorid: 0-100 mg/L - 150 mg/L; unterstützt α-Amylase-Aktivität (Stärke-Spaltung), Malzsüsse und Vollmundigkeit; ab > 300 mg/L salziger Geschmack
-
Kalium: 0-5 mg/L - 10 mg/L; unterstützt Hefestoffwechsel; Malz bringt viel Kalium, zusammen mit Brauwasser-Kalium kann die Maische-Enzymaktivität herab gesetzt werden
-
Sulfat: 0-200 mg/L - 250 mg/L; Ca-Sulfate wirken aciditätsfördernd --> positive Auswirkung auf einige Maischeenzyme; fördert Hopfenblume, ab ca. 180mg/L Gefahr eines trockenen, bitteren Aromas
-
Nitrat: 0-20 mg/L - 40 mg/L; Verschmutzungsindikator --> kann zusammen mit übrigen Salzen Hefe hemmen
-
Eisen: 0-0.1 mg/L - 0.2 mg/L; Katalysator für unerwünschte Bieroxidationen; Behinderung der Verzuckerung; Fehlaromen: rostif, blutig
-
Kupfer: 0-1 mg/L - 2 mg/L; katalysiert Bieroxidation; Hemmung Hefeenzyme
-
Zink: 0-0.5 mg/L - 0.5 mg/L; Spurennährstoff für Hefe; bei zu hohen Konzentrationen Bieroxidation.
Messprinzipien: Die Messung der Ionen auf einfachem Niveau erfolgt meist mit einer kolorimetrischen Methode
(Info). Im Folgenden werden einfache kommerzielle Testbestecke kurz vorgestellt, die sich auch für den Heimgebrauch
für spezielle Fälle eignen. In den meisten Fällen dürfte aber eine Analyse eines staatlichen Wasserlabors genügen,
z.B. Schweiz, Kanton St. Gallen: Amt für Verbraucherschutz und Veterinärwesen, Kantonales Labor, Wasseranalysen
(Info), Analysenspektrum/Preisliste (Info). In den meisten chemischen Standard-Trinkwasseranalysen werden die
Chlorid-, Sulfat- und Nitratkonzentrationswerte erfasst (cf. z.B. hier)
Natrium Na+:
-
für das Heimbraulabor ist eine einfache Analyse nicht möglich (zu aufwändiger apparativer Analysenaufwand
--> cf. hier > Natrium).
Chlorid Cl-:
-
exact iDip Water Testing System, Fotometer (Info): Chloride III (Info 1, Info 2 [Manual]), Vorgehen: Instructions [pdf],
Video; (das allgemeine Vorgehen ist im Braulabor 3 "Bestimmung der Gesamtwasserhärte. Messgeräte und
Vorgehen" beschrieben; cf. hier). Messbereich: 3-600 ppm (mg/L Cl-)
-
Macherey-Nagel Visocolor ECO Chlorid 931 018 (Info). Kolorimetrische Bestimmung von Chlorid: Chlorid-Ionen Cl-
reagieren mit Quecksilber(II)-thiocyanat zu undissoziiertem Quecksilber(II)-chlorid. Das freigesetzte Thiocyanat
bildet mit Eisen(III)-Ionen eine charakteristische Orangefärbung (Anleitung).
Messbereich: 1, 2, 4, 7, 12, 20, 40, 60 mg/L Cl-.
-
Merck Millipore MColortest Chlorid-Test 1.11106.0001 (Info). Titrimetrische Bestimmung mit Titrierpipette: Chlorid-Ionen Cl- werden in salpetersaurer Lösung mit Quecksilber(II)-nitrat-Lösung gegen 1,5-Diphenylcarbazon als Indikatior titriert, wobei gering dissoziiertes Quecksilber(II)-chlorid entsteht. Am Endpunkt der Titration bilden überschüssige Quecksilber(II)-Ionen mit dem Indikator einen blauvioletten Komplex. Die Chlorid-Konzentration ergibt sich aus dem Verbrauch an Titrierlösung (mercurimetrische Bestimmung; Produktbeilage, Analysevorschrift). Messbereich: 2-200 mg/L Cl-, Abstufung: 2 mg/L Cl-.
Kalium K+:
-
Macherey-Nagel Visocolor ECO Kalium 931 032 (Info). Trübungsmessung mit Natriumtetraphenylborat: Kalium bildet mit Natriumtetraphenylborat einen Niederschlag. Unter speziellen Bedingungen kann diese Trübung zur Konzentrationsbestimmung eingesetzt werden (Anleitung). Messbereich: 2, 3, 4, 6, 8, 10, 15 mg/L K+.
Sulfat SO4 2-:
- exact iDip Water Testing System, Fotometer (Info): Sulfate (Info 1, Info 2 [Manual]), Vorgehen: Instructions [pdf], Video; (das allgemeine Vorgehen ist im Braulabor 3 "Bestimmung der Gesamtwasserhärte. Messgeräte und Vorgehen" beschrieben; cf. hier). Messbereich: 1-270 ppm (mg/L SO4 2-.
- Macherey-Nagel Visocolor ECO Sulfat 931 092 (Info). Testbesteck zur Trübungsmessung als Bariumsulfat: Sulfat reagiert mit Barium-Ionen zu einem Bariumsulfat-Niederschlag BaSO4↓. Unter speziellen Bedingungen kann die Trübung zur Konzentrationsbestimmung eingesetzt werden (Anleitung). Messbereich: 25, 30, 35, 40, 50, 60, 70, 80, 100, 120, 150, 200 mg/L SO4 2-.
- Merck Millipore MColortest Sulfat-Test 1.14411.0001 (Info). Kolorimetrisches Verfahren mit Farbkarte und Komparatorblock: Sulfat-Ionen reagieren mit Bariumiodat unter Freisetzung von Iodat-Ionen. Diese oxidieren Tannin zu einer braunroten Verbindung. Die Sulfat-Konzentration wird halbquantitativ durch visuellen Vergleich der Farbe der Messlösung mit den Farbfeldern einer Farbkarte ermittelt (Produktbeilage, Analysevorschrift). Messbereich: 25, 50, 80, 110, 140, 200, 300 mg/L SO4 2-.
Nitrat NO3-:
-
exact iDip Water Testing System, Fotometer (Info): Nitrate (Info 1, Info 2 [Manual]), Vorgehen: Instructions [pdf]; (das allgemeine Vorgehen ist im Braulabor 3 "Bestimmung der Gesamtwasserhärte. Messgeräte und Vorgehen" beschrieben; cf. hier). Messbereich: 025-32 ppm (mg/L NO3-.
-
Macherey-Nagel alpha Nitrat 935 065 (Info). Testbesteck zur kolorimetrischen Bestimmung von Nitrat: Nitrat wird mit einem anorganischen Reduktionsmittel zu Nitrit reduziert. Mit dem Nitrit wird ein aromatisches Amin diazotiert, welches anschliessend zu einem Azofarbstoff gekuppelt wird.
Nitrit stört (gleiche Reaktion). Beseitigung durch Kochen mit Amidoschwefelsäure (Anleitung). Messbereich: 2, 8, 15, 30, 50 mg/L NO3–.
-
Macherey-Nagel Visocolor ECO Nitrat 931 041 (Info). Testbesteck zur kolorimetrischen Messung von Nitrat: Nitrat-Ionen werden im sauren Milieu zu Nitrit-Ionen NO2- reduziert. Diese bilden mit einem geeigneten aromatischen Amin einen orangegelben Azofarbstoff (Anleitung). Messbereich: 0, 1, 3, 5, 10, 20, 30, 50, 70, 90, 120 mg/L NO3-.
-
Merck Millipore MColortest Nitrat-Test 1.11170.0001 (Info). Kolorimetrische Bestimmung mit Farbkarte und Schiebekomparator: Nitrat-Ionen werden zu Nitrit-Ionen reduziert, die in saurer Lösung mit Sulfanilsäure ein Diazoniumsalz bilden. Dieses reagiert mit einem Benzoesäure-Derivat zu einem orangegelben Azofarbstoff. Die Nitrat-Konzentration wird halbquantitativ durch visuellen Vergleich der Farbe der Messlösung mit den Farbfeldern einer Farbkarte ermittelt (Produktbeilage, Analysevorschrift). Messbereich: 10, 25, 50, 75, 100, 125, 150 mg/L NO3-.
Eisen Fe2+/Fe3+:
-
exact iDip Water Testing System, Fotometer (Info): Iron total (Info 1, Info 2 [Manual]), Vorgehen: Instructions [pdf], Video; (das allgemeine Vorgehen ist im Braulabor 3 "Bestimmung der Gesamtwasserhärte. Messgeräte und Vorgehen" beschrieben; cf. hier). Messbereich: 0.03-8 ppm (mg/L Fe2+/Fe3+).
-
Macherey-Nagel Visocolor ECO Eisen 2 931 026 (Info). Kolorimetrisches Testbesteck zur Bestimmung von Eisen nach der Triazin-Methode: Eisen(II)-Ionen bilden mit einem Triazinderivat einen violetten Komplex. Durch vorherige Reduktion werden Eisen(III)-Ionen miterfasst (Anleitung). Messbereich: 0, 0.04, 0.07, 0.10, 0.15, 0.20, 0.30, 0.50, 1.0 mg/L Fe2+/Fe3+.
-
Merck Millipore MColortest Eisen-Test 1.14403.0001 (Info). Kolorimetrischer Schnelltest mit Farbkarte und Komparatorblock: Sämtliche Eisen-Ionen werden zu Eisen(II)-Ionen reduziert. Diese bilden in thioglycolatgepuffertem Medium mit einem Triazin-Derivat einen rotvioletten Komplex. Die Eisen-Konzentration wird halbquantitativ durch visuellen Vergleich der Farbe der Messlösung mit den Farbfeldern einer Farbkarte ermittelt (Produktbeilage, Analysevorschrift). Messbereich: 0.01, 0.02, 0.03, 0.04, 0.06, 0.08, 0.10, 0.15, 0.20 mg/L Fe2+/Fe3+.
-
Kupfer Cu2+:
-
exact iDip Water Testing System, Fotometer (Info): Copper (Info 1, Info 2 [Manual]), Vorgehen: Instructions [pdf]; (das allgemeine Vorgehen ist im Braulabor 3 "Bestimmung der Gesamtwasserhärte. Messgeräte und Vorgehen" beschrieben; cf. hier). Messbereich: 0.6-11 ppm (mg/L Cu2+).
-
Macherey-Nagel Visocolor ECO Kupfer 931 037 (Info). Kolorimetrisches hochempfindliches Testbesteck zur Bestimmung von Kupfer: Kupfer(II)-Ionen bilden mit Cuprizon im schwach alkalischen Medium einen blauen Farbkomplex (Anleitung). Messbereich: 0, 0.1, 0.2, 0.3, 0.5, 0.7, 1.0, 1.5 mg/L Cu2+.
-
Macherey-Nagel HE Kupfer 920 050 (Info). Kolorimetrisches Testbesteck mit Farbscheibe zur Bestimmung von Kupfer: Kupfer(II)-Ionen bilden mit Cuprizon im schwach alkalischen Medium einen blauen Farbkomplex (Anleitung). Messbereich: 0, 0.04, 0.07, 0.10, 0.15, 0.20, 0.25, 0.30, 0.40, 0.50 mg/L Cu2+.
-
Merck Millipore MColortest Kupfer-Test 1.14414.0001 (Info). Kolorimetrischer Schnelltest mit Farbkarte und Komparatorblock: Kupfer(II)-Ionen bilden in ammoniakalischem Medium mit Cuprizon einen blauen Komplex. Die Kupfer-Konzentration wird halbquantitativ durch visuellen Vergleich der Farbe der Messlösung mit den Farbfeldern einer Farbkarte ermittelt (Produktbeilage, Analysevorschrift). Messbereich: 0.05, 0.08, 0.12, 0.16, 0.20, 0.25, 0.30, 0.40, 0.50 mg/L Cu2+.
Zink Zn2+:
-
Macherey-Nagel Visocolor ECO 931 098 (Info). Kolorimetrisches Testbesteck zur Bestimmung von Zink: Zink-Ionen bilden bei pH 8.5 – 9.5 mit Zincon einen Farbkomplex. Saure, alkalische und gepufferte Proben sind vor der Bestimmung auf pH 9 einzustellen (Anleitung). Messbereich: 0, 0.5, 1.0, 2.0, 3.0 mg/L Zn2+.
-
Merck Millipore MColortest Zink-Test 1.14412.0001 (Info). Kolorimetrisch mit Farbkarte und Komparatorblock: Zink-Ionen Zn2+ bilden in schwefelsaurer Lösung mit Thiocyanat-Ionen und Brillantgrün einen blaugrünen Komplex. Die Zink-Konzentration wird halbquantitativ durch visuellen Vergleich der Farbe der Messlösung mit den Farbfeldern einer Farbkarte ermittelt (Produktbeilage, Analysevorschrift). Messbereich: 0.1, 0.2, 0.3, 0.4, 0.5, 0.7, 1.0 2.0, 5.0 mg/L Zn2+.
Abb. 15. Wasseranalysen.
Einfache Testbestecke erlauben es auch dem ambitionierten Heimbrauer, eigene Wasseranalysen durchzuführen.
Einblick in die Vielfalt der Analysen: MERCK, MACHEREY-NAGEL.
Abb. 16. Nachweisverfahren zur Bestimmung weiterer wichtiger Inhaltsstoffe von Brauwasser.
zur Theorie "weitere brautechnisch wichtige Wasserinhaltsstoffe"
3.9. Die Bestimmung der elektrischen Leitfähigkeit und des TDS-Werts ("Total Dissolved Solids" - gelöste Feststoffe) Info
Theoretische Überlegungen und grundlegende Informationen sowie Hinweise zur Bedeutung der Leitfähigkeit bzw. des TDS-Wertes in verschiedenen Phasen des Brauprozess sind unter MUG-MIKROBRAUEREI > Brauwasser zu finden (siehe hier).
Warum bestimmen? Die elektrische Leitfähigkeit des Wassers und des Biers interessiert den Brauer selten direkt. Bei der Wasseranalytik ist aber die Leitfähigkeit ein ausgezeichneter Summenparameter, da sich daraus auf die Wasserhärte als auch auf eine eventuelle Verschmutzung des Wassers einfach und rasch schliessen lässt. Meerwasser leitet Strom ausgezeichnet, während chemisch gereinigtes Wasser nahezu isoliert. Warum ist das so?
Minitheorie. Destilliertes oder "ultrareines Wasser" leitet nicht oder nur sehr gering. Der Grund lässt sich im Wassermolekül selbst finden. Dieses leitet den Strom nämlich nicht selbst, sondern erst, wenn gelöste elektrisch geladene Teilchen, sog. Ionen wie Na+ oder Ca2+ (Ca++) nachweisbar sind. Fehlen diese kann der elektrische Strom durch keine Flüssigkeit geleitet werden. Auch Getränke wie Milch, Bier und Wein leiten den Strom und das bis zu 15fach besser als das durchschnittliche Leitungswasser. Die geringe Leitfähigkeit des Leitungswassers spricht also einerseits für die hohe Qualität. Eine hohe Leitfähigkeit deutet auch auf hartes Wasser hin, wird das doch primär durch einen hohen Karbonatgehalt (Karbonathärte), umgangssprachlich Kalk CaCO3 <--> Ca++ (Ca 2+) + CO3-- (CO3 2-) verursacht. Ist viel Hydrogenkarbonat HCO3- im Wasser enthalten, nimmt es die typisch weisse Färbung an.
Als Nichtkarbonat-Härte bezeichnet man die Verunreinigung durch alle übrigen Mineralien. Kalzium Ca 2+ und Magnesium Mg 2+ bilden die Haupt"verunreinigung", gefolgt von Chloriden Cl-, Nitraten NO3- und Sulfaten SO4--. Diese Stoffe sind bis zu einem gewissen Grad für den Menschen notwendig und damit gesund. Aber auch organische Keime und Ablagerungen von Erde und Dreck tragen zur Verunreinigung bei.
Die Leitfähigkeit des Wassers sagt mit guter Annäherung auch etwas über die Wasserhärte aus. Das Messergebnis der Leitfähigkeit des Wassers durch 10 dividiert ergibt den deutschen Härtegrad, dividiert durch 20 den französischen. Wasser mit einem Wert von 0-140 µS/cm gilt als weich, während man bei einem Wert von über 840 µS/cm von sehr hartem Wasser spricht.
Der TDS-Wert (total dissolved solids - Summe aller anorganische und organischen gelösten Stoffe, meist gelösten Salze (aber auch Feststoffe)) sagt auch etwas über die Fähigkeit der Mineralien aus, das Bier zu "würzen", d.h. sie können sich als Geschmacksträger wirksam zeigen. Der TDS-Gehalt im Wasser (als [ppm] oder [mg/L]) wird durch die üblichen Leitfähigkeitsmessgeräte über den gemessenen Leitfähigkeitsmesswert in µS/cm umgerechnet nach der Formel Anzeigewert TDS (in [mg/L]) = Leitfähigkeit (in [µS/cm] x C.tds (Umrechnungsfaktor), wobei für den Faktor C.tds häufig ein gemittelter Standardwert von 0,67 eingesetzt wird (C.tds-Werte: 0.50 einwertige Salze mit 2 Ionenarten (NaCl, KCl u.ä.) und natürliche Wässer/Oberflächenwässer, Trinkwasser; 0.65-070 Salzkonzentration von wässrigen Düngerlösungen).
Der mineralische Gesamtgehalt verleiht dem Bier eine Geschmacksstruktur, die als weich, mittel oder kräftig umschrieben werden kann.
Messeinheiten:
Die elektrische Leitfähigkeit des Wassers lässt sich in Siemens pro Zentimeter messen. Die gängigsten Grössen sind dabei Mikrosiemens (µS/cm) und Millisiemens (mS/cm; 1 mS/cm = 1'000 µS/cm).
Typische Messwerte: destilliertes Wasser < 1 µS/cm, Regenwasser 5-30 µS/cm, Quellwasser 80-130 µS/cm,
Leitungswasser Fontnas 261 µS/cm; Trinkwasser allg. < 500 µS/cm, wässrige Kochsalzlösung 700 mg NaCl/1 L
1'000 µS/cm, Bäche/Flüsse < 1'000 µS/cm, industrielles Abwasser 5 mS/cm = 5'000 µS/cm, Meerwasser 45-56 mS/cm
= 45'000-56'000 µS/cm.
Der TDS-Gehalt wird in ppm (Teile je einer Million Teile) und mg/L (mg pro Liter) angegeben (Info).
Brauwasser: empfohlener Wert< 500 ppm [Palmer/Kaminski, 2013].
Messprinzip: Die Messung der elektrischen Leitfähigkeit erfolgt über eine Widerstandsmessung. Im einfachsten
Fall besteht die Messzelle aus zwei metallischen Elektroden, zwischen denen eine Wechselspannung angelegt
wird. Je mehr Ionen die Messlösung enthält, desto grösser ist der zwischen den Elektroden fliessende Strom.
Mit dem Ohm’schen Gesetz wird daraus die Leitfähigkeit berechnet (µS/cm) und zusätzlich lässt sich aus der Leit-
fähigkeit durch gewisse Vereinfachungen auch gerade noch eine TDS-Messung bzw. TDS-Berechnung als [ppm] bzw.
[mg/L] machen.
Genaues Vorgehen: PDF-Dokument "Bestimmung der elektrischen Leitfähigkeit/TDS-Wert"
Abb. 17. Bestimmung der Leitfähigkeit + TDS in Brau-wasser, Bierwürzen und Bier.
Im Bild: Weizenbier 1:1 verdünnt für die Messung.
3.10. Die Bestimmung des gelösten Sauerstoffgehalts (engl. DO - Dissolved Oxygen)
3.10.1. Unerwünschter Sauerstoff beim Brauprozess
Sauerstoff ist im Brauprozess fast immer höchst unerwünscht, denn hohe Sauerstoffwerte beeinflussen die Qualität des Bieres, seine Geschmacksstabilität und Haltbarkeit sehr negativ. Unter den Faktoren, die für die Bieralterung verantwortlich sind, gehört Sauerstoff zu den wichtigsten Einflussfaktoren. Interessanterweise scheint aber nicht das O2-Molekül direkt reaktiv zu sein: die eigentliche bierschädliche Oxidation wird erst durch den Prozess der Sauerstoffaktivierung angestossen. Erst über die Stufen Hyperoxid O2- --> Wasserstoffperoxid H2O2 --> Hydroxylradikal OH. ist es hoch reaktiv und reagiert sofort mit Bierinhaltsstoffen und löst bierschädliche Vorgänge aus.
Am Ende der Gärung und Reifung des Bieres ist der gelöste O2-Gehalt auf 0.0 bis 0.01 mg/L. Dieser Tiefstwert ist aber im weiteren kaum zu halten, denn folgende Teilprozesse im gesamten Brauprozess lassen wieder geringe O2-Mengen ins Bier: Filtration (Profibrauerei), Lagertanks, Nachkarbonisierung, Abfüllen in Flaschen (Kopfraum/Flaschenhals!, kleinste Luftblasen an Glaswand), Diffusion durch Kronkorken bzw. Gummidichtung bei Bügelflaschen. Der Gesamtgehalt an Sauerstoff im abgefüllten Bier soll 0.10 bis 0.15 mg O2/L nicht überschreiten. Bereits 2 mL Luft im Kopfraum einer 500 mL Flasche erhöhen den Sauerstoffgehalt um mehr als 1 mg O2/L.
Der Heimbrauer hat folgende Möglichkeiten, unerwünschten O2-Eintrag und Auswirkungen zu vermeiden: --> cf. ausführlicher in PDF-Anleitung > S. 2.
-
POS: Brauwasser: mehr Sulfat im Brauwasser durch Calciumsulfat (Braugips) bis 150mg/L, in Ales bis 300mg/L
-
POS: Einsatz von viel Hopfen, dunklen Malzen und Caramalzen
-
POS: immer mit möglichst vollen Gärbehältern, Fässern und Flaschen arbeiten
-
NEG: Nachgärung nicht in grossem Gärtank durchführen und nachher mit CO2-Druckflasche karbonisieren
-
POS: Bier nach abgeschlossener Karbonisierung möglichst kalt (0°C < 10°C) lagern.
-
POS: beim Umfüllen vom Gärbehälter in anderen Behälter zum Stopfen und/oder in Abfüllbehälter unbedingt mit Schlauch/Siphonsysteme arbeiten (nie "plätschern" lassen!); dieser muss fest sitzen, um keine Luft zu ziehen und sollte bis zum Boden des Zielgefässes reichen
-
POS: Verkleinerung des Volumens im Kopfraum und Flaschenhals durch maximale Füllmenge
-
POS: Nachgärung in Bierflaschen mit natürlicher Karbonisierung mittels Hefen: Bierflaschen mit Kronkorken verschliessen,
-
NEG: Bügelverschluss mit Gummidichtung eher meiden
-
POS: Abfüllen der Bierflaschen unter CO2-Spülung, z.B. mit der BeerGun (Info1, Info2, Video)
-
POS: sauerstoffabsorbierende Kronkorken verwenden (O2-absorbierende Kronkorkeneinlage, feucht aktiv. Bsp. hier)
-
NEG: Bier lang lagern unter Lichteinwirkung und bei höheren Temperaturen (z.B. Zimmertemperatur)
-
POS: Bier FRISCH TRINKEN bevor sich die oxidativen bierschädigenden Reaktionen bemerkbar machen (ABER: zuviel trinken kann sich auch schädigend auswirken !).
Literatur: cf. brau!magazin, Winter 2014/15, A. Staudt "Oxidation und Bieralterung" hier. Hefestoffwechsel stark vereinfacht: Explore yeast (Lesaffre)
3.10.2. Erwünschter Sauerstoff bei der Hefevermehrung
Sauerstoff ist aber im Brauwesen nicht immer unerwünscht, denn bei der Anzucht von Hefen und natürlich ganz wichtig beim Anstellen der Bierwürze nach dem Sud, der Anstellwürze, muss zwingend Sauerstoff in die Würze gebracht werden. Warum? Hefezellen sind zwar Alleskönner in stoffwechselphysiologischer Hinsicht. Sie beherrschen sowohl den aeroben, also sauerstoff-abhängigen Atmungsstoffwechsel, der sehr energieergiebig ist: aus 1 Molekül Zucker (Glukose, C6H12O6 - dem wichtigsten Kohlenhydrat überhaupt) holen sie 32 biologische Energieeinheiten ATP heraus:
-
Atmungsstoffwechsel als Grundlage des gesamten Stoffwechsels inkl. Fortpflanzung und Vermehrung: C6H12O6 + 6 O2 ----> 6 CO2 + 6 H2O + 32 ATP
-
Gärungsstoffwechsel (anaerob, ohne O2) als Notenergiestoffwechselprogramm bei O2-Abwesenheit: Bsp. alkoholische Gärung
C6H12O6 ----> 2 C2H5OH + 2 CO2 + 2 ATP
Die Hefe kann bei Sauerstoffabwesenheit zwar immer noch biologische Energieträger ATP gewinnen, aber nur einen Bruchteil der bei aeroben Verhältnissen gewinnbaren ATP-Einheiten (1/19 = ca. 5% der aeroben Energieausbeute beim Abbau von Kohlenhydraten wie Traubenzucker). Beim Gärstoffwechsel verfügt sie sozusagen nur noch "Überlebensenergie", um mit dem eigenen Grundstoffwechsel sich selbst gerade noch am Leben zu halten. Um sich fortpflanzen und vermehren zu können - beides sehr energieintensive Prozesse - braucht sie die volle Energieleistung des aeroben Atmungsstoffwechsels. Für eine problemlose Vermehrung benötigt die Hefe essenzielle Lipide (Fettmoleküle) und auch ungesättigte Fettsäuren, welche für den Zellaufbau benötigt werden und diese Synthesen werden erst bei genügender O2-Zufuhr aktiviert. Daher muss die Bierwürze nach der Beimpfung mit der Anstellkultur, die ja ihrerseits auch genügend Sauerstoff zur Anzucht (= Vermehrung der Hefezellen) erhalten musste, mit Luft-Sauerstoff (20.95 Vol.-%) oder reinem Sauerstoff begast werden. Da Sauerstoff relativ schlecht wasserlöslich ist, müssen Nährlösungen zur Hefeanzucht wie Anstellbierwürze intensiv belüftet werden, um die erforderliche physikalisch gelöste O2-Menge zu erreichen. Richtwerte für den O2-Gehalt in [mg O2/mL]: 5.5 - 8 bei ca. 12%iger Würze. Eine Überbelüftung z.B. durch zuviel O2 aus einer O2-Gasflasche wiederum kann oxidativen Stress mit Radikalbildung durch Induktion radikalbildender Enzyme auslösen.
Zusammenfassend: Sauerstoff ist die Grundlage für gesunde vitale Hefen, was wiederum in besserem Vergärungsgrad, vollständigerer Fermentation, kürzeren Gärzeiten, weniger stagnierenden Gärungen und weniger Fehlaromen resultiert.
Wie kann man nun die optimale O2-Begasung erreichen und messtechnisch erfassen, insbes. bei Begasung mit reinem O2?
3.10.3. Die Bestimmung von gelöstem Sauerstoff
Sauerstoff für die Startphasen des Wachstums. Ist die Bierwürze nach dem Sud rasch auf die
geeignete Anstelltemperatur abgekühlt worden, i.d.R. etwa 1-2 °C unter der optimalen
Temperatur der Hauptgärung, muss nun diese Anstellwürze ausreichend Sauerstoff für die
Hefevermehrung enthalten. Erst der optimale gelöste O2-Gehalt ermöglicht der Hefe zu Beginn
des Wachstums in der sog. lag- und dann insbesondere der exponenziellen Wachstumsphase
(cf. Abb. 34 in "Brauwasser" hier) eine starke Vermehrung und darauf dann, wenn der O2
verzehrt ist, eine zügige Gärung. Belüftung sollte nur in der abgekühlten Würze durchgeführt
werde, ist doch der O2-Gehalt stark von der Temperatur abhängig (Abb. 33 in "Brauwasser",
cf. hier), je kühler, desto mehr O2 kann in die Bierwürze gebracht werden.
Belüftungsverfahren. Sauerstoff kann auf ganz verschieden Arten in Lösung gebracht werden:
-
Kräftiges Schlagen bzw. Einrühren der Anstellhefen in die Bierwürze mit einer desinfizierten
Bierrührkelle, bis sich viel Schaum gebildet hat - variabel je nach Kellengrösse
--> 2 - 3 mg O2/L [ppm] O2
2. Bierwürze mehrfach plätschernd umgiessen --> < 4 ppm O2
3. Kräftiges Schütteln des Gärbehälters mit Umgebungsluft - 45 sec bis 5 min --> 2.7 - 4,
max. 8 ppm O2
4. mit desinfizierter Bierrührkelle an Bohrmaschine Luft-O2 einrühren -5 min --> 8 ppm O2
5. mit Aquariumpumpe via 0.2 µm Sterilfilter*, Silikonschlauch* und Edelstahlbelüftungs-
stein* (cf. Abb. 18) - 5 - 15 min --> ca. 8 ppm O2 (*: sterilisiert)
6. Schütteln des geschlossenen Gärbehälters mit reinem O2 - 45 sec --> 10 ppm O2
7. Begasung mit reinem O2 über Belüftungsstein" 30 sec --> 5.1 ppm/ 1 min --> 5.1 ppm/
1.5 min --> 9.2 ppm/ 2 min/ --> 14.1 ppm bis max. 26 ppm O2.
Bewertung: Verfahren 1 - 4 sind mikrobiologisch gesehen "keimanfällig", 5 - 7 empfehlenswert.
Bestimmung von gelöstem Sauerstoff O2 (DO). Der gelöste Sauerstoff kann mit amperometrischen
O2-Sensoren bestimmt werden (Clark-Prinzip). Amperometrische O2-Sonden bestehen aus einer
Arbeitselektrode (Goldkathode) und einer Gegenelektrode (Silberanode), die in einer gemeinsamen
Kammer von einer Elektrolytflüssigkeit umspült werden. An beiden Elektroden wird Gleichspannung
angelegt. Sauerstoff gelangt über Permeation aus dem Messmedium Bierwürze durch eine Membran
in den Elektrolyten und wird an der Arbeitselektrode in Strom umgewandelt. Die Gegenelektrode hält
durch eine chemische Reaktion das System am Laufen. Der resultierende Strom ist proportional zum
Sauerstoffpartialdruck im Biermedium (Info, Video [bis 3:50 min]).
Genaues Vorgehen zur Bestimmung des gelösten Sauerstoffs inkl. Hinweise zur Vermeidung von O2-Eintrag:
PDF-Dokument "Bestimmung des gelösten Sauerstoffs"
Weitergehende Informationen auf dieser Website:
- zum Hefestoffwechsel aerob - anaerob: cf. hier
- Kurzeinführung Stoffwechsel mit Grafik: cf. hier > Abb. 1

Abb. 18. Belüftungsvorrichtung mit Luftsauerstoff.
Eine Aquariumpumpe saugt nichsterile Umgebungsluft an, die über einen 0.2 µm Sterilluftfilter* und Silikonschlauch* aus einem Edelstahlbelüftungsstein* dann steril in die temperierte Anstellwürze strömt (*: sterilisiert).
Abb. 19. Messgerät für Gelöstsauerstoff.
EXTECH ExStik D0600 mit Bedienungsanleitung, Elektrodenaufbewahrungskappe, Ersatzmembran, Elektrolytlösung (Info).
3.11. Die Bestimmung der "mikrobiellen Belastung" durch Erfassen der "Kolonie bildenden Einheiten (KBE)"
3.11.1. Mikroorganismen im Trinkwasser
Lebensmittel dürfen Inhaltsstoffe, Zusatzstoffe, Fremdstoffe und Mikroorganismen nur soweit enthalten, als dadurch die Gesundheit nicht gefährdet werden (Art. 10 Lebensmittelgesetz [LMG]). Als Mikroorganismen werden folgende Gruppen von Kleinstlebewesen bezeichnet:
• Viren (Sommergrippe, Hepatitis, Kinderlähmung, u.v.a.)
• Bakterien (Kolibakterien, Salmonellen, Legionellen, u.v.a.)
• Parasiten (Giardia, Cryptosporen, u.a.)
• Schimmelpilze und Hefen.
Viele dieser Mikrolebewesen sind für Mensch und Tier harmlos oder sogar nützlich. Nicht wenige reinigen sogar die Umweltgewässer wie Fliessgewässer (natürliche Selbstreinigung). Andere allerdings sind wiederum für schwere Erkrankungen verantwortlich und haben deshalb keine Berechtigung in Lebens-mitteln, worunter natürlich auch das Trinkwasser fällt. Je keimärmer Wasser ist, desto geringer ist ein Infektionsrisiko. Insbesondere dürfen keine Fäkal-bakterien in Trinkwasser nach zuweisen sein.
3.11.2. Mikroorganismen im Brauwasser
Als Brauwasser dient in der Regel das lokale Trinkwasser. Je nach Bierstil muss es entweder noch modifiziert werden (z.B. Wasserenthärtung durch Zugabe von Braugips [Calciumsulfat Ca)SO4)2], oder u.U wird es sogar gänzlich aufbereitet, im Extremfall aus destilliertem bzw. entionisiertem Wasser. Je nach Herkunft des Wassers (Quellwasser, Grundwasser, Fluss-/Seewasser) muss es vom Wasserlieferanten gereinigt und entkeimt werden. Das im Hause zapfbare Wasser muss also trinkfähig und entsprechend ohne Fäkalkeime und einer Maximalzahl "normaler Keime" (= sauerstoffabhängige Keime - aerobe mesophile Keime) im Verteilernetz beladen sein. Das zuständige Wasseramt liefert i.d.R. die Resultate der physikalisch-chemischen und mikrobielle Beprobung (Bsp. Schweiz: Stadt St. Gallen, Stadt Zürich, Dorf Fontnas; Deutschland: Stadt München: Österreich: Stadt Wien).
Fazit: Trinkwasser als Brauwasser eingesetzt stellt i.d.R. mikrobiologisch gesehen kein Problem dar, wenn der Wasserversorger die gesetzlich vorgeschrie-benen Qualitätsziele kontinuierlich überprüft und erreicht sowie kommuniziert. Zudem wird ja das Brauwasser im Brauprozess während der Sudphase genügend lange zum Kochen erhitzt, dass es dabei eigentlich sterilisiert wird.
3.11.3. Nachweis von aeroben mesophilen Mikroorganismen ("Gesamtkeimzahl")
Warum "Keimzahlen" bestimmen?
Wieso soll sich nach den oben erwähnten Fakten der Heimbrauer überhaupt mit der Bestimmung der "Keimzahlen" im Wasser beschäftigen? Wasser ab Wasserhahn ist nie keimfrei und je länger es bei Zimmertemperatur stehen bleibt, desto höher sind die Keimzahlen. Dies kann z.B. in Gefässen wie Gär-tank, Wasserflaschen, Bierflaschen, Wasserbeckenu.a. zu eigentlichen Bioüberzügen auf der Oberfläche, sog. Biofilmen (bzw. mikrobielle Matten) führen. Ein immer eindrückliches Beispiel ist der Wasserbehälter in der Kaffeemaschine, der einige Tage stehen gelassen wurde: die innere Oberfläche fühlt sich bei Berührung schmierig-glitschig an. Ebenso kann sich in den Aufbewahrungsbehältern und Spritzflaschen von entionisiertem oder destilliertem Wasser im Laufe der Zeit ein solcher Biofilm entwickeln! Werden gar nährstoffhaltige Lösungen ungekühlt einige Zeit aufbewahrt, dann können sich die Mikroorganis-men gar explosionsartig vermehren. Von daher kann es von Interesse sein, selbst einmal diese "Keimzahlen" in Trinkwasser, gestandenem Wasser, dest./ention. Wasser oder wässrigen Lösungen zu verschiedenen Zeitpunkten des Aufbewahrens bei Zimmertemperatur oder Kühlschranktemperatur zu bestimmen!
Wie "Keimzahlen" bestimmen? Der klassische Keimzahl-Plattentest
Die Bakterienzahl wird indirekt als "Keimzahl im Plattentest", d.h. durch die Bestimmung
der vermehrungsfähigen Keime auf einem geeigneten Nähragar als "Koloniezahl" abge-
schätzt. Da sich Bakterien durch exponentielles Wachstum vermehren, d.h. 1 Bakterium
--> 2 B. --> 4 --> 8 --> 16 --> n (--> ist jeweils eine Generationszeit, bei Escherichia coli z.B.
20 min, bei Milchsäurebakterien 60-90 min). Nach einem halben Tag bis 2 Tagen kann n =
ca. 10^7 - 10^9 Bakterien sein, wobei diese riesige Zahl von sonst einzeln unsichtbaren
Bakterien dann in einer von blossem Auge sichtbaren Bakterienkolonie manifestiert.
Überall dort, wo 1 oder mehr Bakterien auf dem Nähragar ursprünglich gelandet sind,
entstehen sichtbare Bakterienkolonien, die dann leicht ausgezählt werden können: von
daher werden sie heute als KBE bezeichnet, als Kolonie bildende Einheit (cf. Abb. 18).
Eine KBE entspricht ursprünglich mindestens einem Bakterium, je nach dem Ausplattier-
verfahren (und evtl. Verdünnung der untersuchten Probe) aber auch mehreren
"Ursprungsbakterien". Von daher ist der KBE-Wert immer ein Minimalwert der Keimzahl!
Genaues Vorgehen zur Bestimmung der Keimzahlen als KBE: PDF-Dokument "Gesamtkeimzahl - KBE aerober
Informationen zu Bierschädlingen allgemein und deren Nachweis siehe Bierschädlinge allgemein, Nachweis von
Bierschädlingen (in Vorbereitung).
Hinweis Durchflusszytometrie: Diese herkömmliche Keimzahl- bzw. Kolonie-Plattentest-Methode ist alles andere als exakt. Man hat inzwischen herausgefunden, dass auch in einwandfreiem Trinkwasser zwischen 100- und 10'000-mal mehr Bakterien leben als die Kolonieauszählmethode ergibt. Nun wird in der Schweiz, gestützt auf Forschungen des der ETHZ-zugehörigen Wasserforschungsinstituts Eawag eine neue Art der Messung eingeführt, die Durchflusszytometrie. Sie basiert auf der Einfärbung der lebenden Bakterien mit einem Fluoreszenzfarbstoff, der sich an deren Erbsubstanz DNA bindet. Das Wasser wird dann durch eine enge Kapillare geschickt, wobei Laserstrahlen die Bakterienzahlen und gleichzeitig auch deren Grössenverteilung erfassen. Dabei resultieren weitaus höhere "Keimzahlen".
Mehr Info zur Durchflusszytometrie hier.
Ein typisches Beispiel einer klassischen Methode im Vergleich zur Durchflusszytometrie und deren Interpretation hier (S. 2 unten "Totalzellzahl")..
3.11.4. Bestimmung "heikler" Keime im Wasser - ein Kurzabriss
Wasser wie auch Trinkwasser ist immer mit Keimen belastet. Vollständig keimfreies Trinkwasser gibt es nicht. Als Keime bezeichnet die Medizin alle krankheitserregenden Mikroorganismen wie Bakterien, Pilze, Viren und Parasiten, die potenziell unsere Gesundheit gefährden können. Gesundheitliche Risiken sind allerdings erst dann zu befürchten, wenn gewisse Mikroorganismenarten in erhöhter Konzentration nachgeweisen werden können. Solche heiklen gesundheitsgefährdenden Keime sind z.B. gewisse Escherichia coli-Arten (Kolibakterien), Enterokokken, Legionellen, Salmonellen , Pseudomonaden ("Pfützenkeime", Pseudomonas aeruginosa (Boden- und Wasserkeim, gefürchteter "Nasskeim"), u.a. (gute Broschüre hier!).
Solche Keime zu bestimmen ist in den meisten Fällen zu aufwändig und für den Brauer auch gar nicht nötig, denn spätestens beim Sud wird all diesen Organismen der Garaus gemacht. Es gibt heute allerdings summarische Nachweisverfahren, die keimbelastetes "schlechtes" Wasser sichtbar machen.
xxxxxxxx yyyyyyyyyyyyy Text folgt.

Abb. 20. Bakterien wachsen explosionsartig, das Wachstum wird als exponentiell bezeichnet.

Abb. 21. Sichtbarmachung von Mikroorganismen durch Vereinzelung der Mikroorganismen auf einem verfestigten Nährmedium ("Nähragar") mittels Ausplattieren (Info).
1: Ausbringen einer definierten Probemenge, z.B. 0.1 mL Wasser, auf einen spezifischen Nähragar
2: Ausplattieren mit dem Glasspatel ("Drigalski-Spatel")
3: Wachstum von Kolonien nach 2 Tagen.
Durch Auszählen der gewachsenen Kolonien und dem ausplattierten Probevolumen kann die "Gesamt-keimzahl" abgeschätzt werden. Bsp.: Abb. 21.3: 77 Kolonien, 0.1 mL Wasser ausplattiert --> 770 KBE/mL. Das wäre eine für Trinkwasser nicht mehr zulässige Keimzahl (Toleranzwert 300/mL).
Definition: aerobe mesophile Keime - die Zahl von aeroben (= Sauerstoff-bedürftigen) mesophilen (= optimal zw. 20-45 °C wachsenden) Keimen (AMK) ist ein Mass für die allgemeine mikrobielle Belastung bzw. Verunreinigung in einem Produkt. AMKs repräsentieren Bakterien, Hefekeime und Schimmelpilze.
Siehe auch Braulabor 11 hier > S. 3
Abb. 22. Bestimmung von Keimzahlen als KBE - Kolonie bildende Einheiten.
Material dazu: Alkohol zum Abflammen des Glas-spatels in Glaswanne mit Deckel, Petrischale, gefüllt mit spezifischem Nährboden (z.B. Universalnähragar, Agar für Bierschädlinge, u.a.). Das ausgestrichene (ausplattierte) Wasservolumen muss genau bekannt sein - mit zunehmender Genauigkeit mit z.B. 1.0 mL Pasteurpipette (Anzahl Tropfen von bekanntem Volu-men), 1 mL Messpipette (1/100 mL Graduierung), Mikropipette (z.B. 100-1'000 μL).
Abb. 23. Iodprobe: Bestimmung der Iodnormalität, d.h. den vollständigen Zuckerabbau.
Obere Reihe: Maische nach Proteinrast --> positive Iodprobe
viel Stärke; Maische vor dem Läutern: Erreichen der Endver-zuckerung = Iodnormalität; Lugolsche Lösung, Eigenfarbe.
Untere Reihe: geschrotetes Malz, positive Stärkeprobe, viel Stärke; Maische aus Mitte erster Verzuckerungsphase, noch nicht iodneutral, wenig Stärke.
3.12. Weitere wichtige bzw. wünschenswerte Analysen für das Braulabor
3.12.1. Stärkenachweis
Die Iodprobe: Qualitativer Nachweis von Stärke.
Der enzymatische Malzstärkeabbau zu Zuckereinheiten beim Maischen, also die Verzuckerung von Stärke als Substratgrundlage der nachfolgenden alkoholischen Gärung durch die Hefen kann wie folgt beschrieben werden:
Stärke (Glu-Glu-Glu- ....Glu)n + Malzenzyme wie α- und β-Amylase --> Glu-Glu (Maltose) [Glu = Glukose C6H10O5 Summenformel der Wiederholeinheit]
Malzzucker C12H22O11 + H2O + Enzym Maltase --> 2 Glukose C6H12O6 + Enzyme der alkoholischen Gärung --> 4 Ethanol C2H5OH + 4 CO2.
Der Maischeprozess ist dann erfolgreich abgeschlossen, wenn die wasserunlösliche und unvergärbare
Stärke des Malzkorns in die durch Hefe vergärbare Zucker zerlegt ist bzw. der beim Maischen
gewonnene Extrakt keine unverzuckerte Stärke mehr enthält. Solange noch Stärke vorhanden ist, wird
sich die Probe blau färben und die Verzuckerungsrast ist länger zu halten.
Prinzip Stärkenachweis: Stärke kann leicht nachgewiesen werden, da sie mit einer Iodlösung eine
intensive blau bis rotviolette Färbung ergibt. Mit Iod meist als I5- bildet Stärke eine charakteristisch
gefärbte Einschlussverbindung, in dem je ein Iodmolekül in die Spirale des Molekülgerüstes eingelagert
wird. Eine optimale Endverzuckerung bedeutet also das Fehlen von Stärke und damit auch das
Fehlen der beschriebenen Farbreaktion. Die vollständige Endverzuckerung wird mit der sog.
Iodnormalität erreicht und nachgewiesen, indem die Iodlösung an der Eintropfstelle seine braun-
gelbe Eigenfarbe behält, also weder eine Blau-violett noch eine Rotfärbung auftritt (Abb. 23, oben
rechts).
Eingesetzte Iodlösungen:
1. Iod-Kaliumiodid-Lösung I2 . KI (Lugolsche Lösung, Kaliumtriiodid):
Elementares Iod I2 löst sich kaum in Wasser; liegen jedoch schon gelöste Iodid-Ionen vor wie z.B.
aus dem Salz KI <--> I- + K+, so löst sich das Iod unter Bildung von Polyiodidionen:
2 I2 + I- ⇆ I3- + I2 ⇆ I5- . Diese Lugolsche Lösung ist von bräunlichroter Farbe und charakteris-
tischem Geruch mit einem Massenverhältnis von 1:2 von Iod zu Kaliumiodid in Wasser.
2. Iodtinktur:
Iod ist sehr viel besser in Ethanol als in Wasser löslich. Ist Iod in Ethanol gelöst, bezeichnet man
die Lösung als Iodtinktur, eine Lösung von Iod in 10 Teilen Alkohol. Nachteil: entflammbar, verdunstet.
Genaues Vorgehen (qualitativer Nachweis): PDF-Dokument "Iodprobe: Nachweis von Stärke"
Ausführliche Info zum Stärkenachweis. Theorie
Quantitativer Stärke-Nachweis:
Beim kreativen Experimentieren mit neuen Stärkesubstraten wie z.B. Rohgetreide, Mais, Früchten (Bananen) u.a. wäre es interessant, im voraus den Stärke- gehalt im Vergleich zu den üblichen Malzsorten zu kennen. Einen für den Heimbrauer geeigneten einfachen quantitativen, nasschemischen Stärkenach-weis gibt es leider nicht. Im lebensmittelchemischen Labor macht man es vor allem mit Hilfe des nahen Infrarots (NI, NIR) im Bereich um 1 µm (genau zwischen 0.84-1.2 µm). Es gibt auch Messungen der Transmission (NIT) sowie der Reflexion (NIR).
3.12.2. IBU International Bitter Units:
Sensorischer Hopfengenuss.
Für den Biergenuss wird der Hopfen sensorisch auf drei Arten eingeteilt: 1 Bitterkeit, Aroma mit den Komponenten 2 Geschmack und 3 Geruch. Aromahopfen vermittelt einen angenehmen Hopfengeschmack mit mehr oder weniger ausgeprägter Hopfenblume, hat dafür einen eher niedrigen Bitterstoffgehalt. Bitterhopfen dagegen weisen durchwegs einen hohen Gehalt an Bitterstoffen mit häufig unedlen Aromakomponenten. Allerdings gibt es neuere Hopfenvarianten mit beiden Eigenschaften wie z.B. die Aromasorten Aurora (Info) oder Perle (Info).
Bitterstoffe oder Bitterharze.
Zunächst bilden die Hopfenpflanzen die β-Säuren
(Lupulone, Info), die nur wenig bitter sind und in
die sich bildenden Lupulindrüsen sezerniert
werden (cf. Abb. 24). In den nachfolgenden
Reifungsprozessen wird ein Teil dieser Beta-
Säuren zu den deutlich bittereren Alpha-Säuren
(α-Säuren), Humulone, Info) umgebaut. Die
wesentlichen Bitterstoffe im Hopfen sind die
also diese Alphasäuren bezeichneten Humulone,
die keine einheitliche Verbindung darstellt (Unter-
teilung in n-Humulon, Adhumulon, Cohumulon).
Dieser α-Säuregehalt beträgt bei Aromahopfen
im Durchschnitt 4 - 5 %. Die sog. Hochalpha-
sorten können bis zu 17 % α-Säuren enthalten
(Bsp. Nugget [Info], Hallertauer, Magnum [Info],
Herkules [Info].
Die unpolaren Alpha-Säuren im Weichharz
des Hopfens sind unlöslich im Wasser und
werden erst im Verlaufs des Würzekochens in
eine bierlösliche Form ungewandelt. Diese Strukturumwandlung der Alpha-Säuren, bei gleichbleibender
chemischer Summenformel Isomerisierung genannt (Info), bildet wasserlösliche Iso-α-Säuren, welche für
die Bitterkeit im fertigen Bier verantwortlich sind (Info). Die Bitterstoffausnutzung zu bis 30 % wird primär
durch die Hopfenkochzeit bestimmt: je länger eine Hopfengabe gekocht wird und je höher der Extraktgehalt
der Würze ist, desto höher ist die Bitterstoffausnutzung. Allgemein gilt, dass die Ausnutzung umso geringer
ist, je kürzer die Temperatur über 80 °C ist und je konzentrierter die Würze ist (cf. Abb. 25).
Mass für die Bitterkeit - IBU.
Die International Bitterness Units (IBU), ursprünglich EBU (European Bitterness Unit), ist eine von der
European Brewery Convention (EBC) festgelegte Masseinheit (Bittereinheit) für den alpha-Säure-Anteil
im Bier. Was ist nun die "richtige" Dosierung und wie bestimmt man den Bitterkeitsgrad in IBU?
Bei der "Messung" der Bierbitterkeit stösst man auf methodische Schwierigkeiten, da die gemessene
Bitterkeit und die im Gaumen empfundene Bitterkeit nicht identisch sind: neben der objektiven mess-
baren Grösse bestimmen die Restsüsse und das Hopfenaroma die subjektive Bitterkeitswahrnehmung.
Bestimmung der α-Säuren in [%] und Iso-α-Säuren in IBU-Einheiten.
Letztlich müsste man 3 verschiedene Grössen messtechnisch erfassen können:
-
Bitterstoffe in Hopfenprodukten: Unspezifische Bestimmung des Gehalts der α-Hopfenbittersäuren
des jeweiligen Hopfens, d.h. den α-Säuregehalt in [%]. Die Analysenwerte sind sortentypische Werte
zum Zeitpunkt der Ernte, können jedoch abhängig von Erntejahr, Anbaugebiet, Pflanzer und Alterungs-
grad variieren. Der Alphasäuregehalt wird gemäss der European Brewery Convention EBC 7.4 (Info)
mittels konduktometrischer Titration mit Bleiacetat-Lösung bestimmt. Diese Methode kann für alle
Hopfenprodukte angewandt werden, wie z.B. Hopfendolden, Hopfenpellets oder Hopfenextrakte (Info > PDF).
Weitere unspezifische Bestimmungsmethoden von Bitterstoffen sind spektralphotometrische Verfahren (Toluolauszug, Messung im UV-Bereich 275, 325,
355 nm, Info) und spezifische Analysenmethoden wie HPLC (High Performance Liquid Chromatography, Hochleistungsflüssigkeitschromatographie, Info).
2. Bitterstoffe im Bier: Die Bitterkeit des Endproduktes Bier. Dieser Wert kann ebenso spektralphotometrisch in einem Isooctanauszug des Bieres gemessen werden oder auch berechnet werden. Entscheidend für den IBU-Wert ist die Konzentration an Iso- Alpha-Säuren des gebrauten Bieres. So ist eine International Bitterness Unit (IBU) als 1
Milligram gelöster Iso-Alpha-Säuren pro Liter Bier definiert. Ein weiteres Verfahren ist die HPCL-Analytik (High Performance Liquid Chromatography, Info1, Info 2).
3. Die Wahrnehmung der Bitterkeit des Bieres. Diese rein subjektive Grösse hängt 1. von
der objektiv messbaren Iso-Alpha-Säuregehalt, 2. dem Verhältnis von Bittere zur
Stammwürze (Abb. 26), 3. der Restsüsse und 4. dem Hopfenaroma ab. Dieses
komplexe Wechselspiel kann nicht analytisch objektiv erfasst, sondern höchstens
individuell-subjektiv beschrieben werden (z.B. mit Hilfe einer standardisierten
Verkostungsvorlage z.B. in Brücklmeier, Bier Brauen, 2018, S. 440-441).
Für den Heimbrauer sind weder konduktometrische noch spektralphotometrische oder
HPCL-Bestimmungen zugänglich. Es bleiben Berechnungsverfahren zur Abschätzung der
einzusetzenden Hopfenmengen und der resultierenden Bitterkeit im Bier übrig. Dazu
werden publizierte und eigene Daten benötigt.
Vertiefende Informationen zur Bierbitterkeit sind auf der Theorieseite "Brauwasser" zu finden
(siehe hier).
Direkt zur PDF-Anleitung "Berechnung der Bitterkeitswerte" geht es hier.

Abb. 24. Lupulindrüsen: Die "Wunderdrüsen" der Hopfendolde.
Links: Vorblätter der Hopfendolde mit Lupulindrüsen am unteren Ende auf den Taschenfalten der Vorblätter.
Mitte: auf den Vorblättern sitzen die einzelnen becherförmigen Lupulindrüsen (d = 0.2 mm, aus rel. wenigen Zellen bestehend).
Rechts: Voll gefüllte Lupulindrüsen auf dem Vorblatt einer Hopfendolde. Ausführlichere Bildfolge hier.
Bilder: K. Frischknecht, Leica Stereomikroskop M165 C]

Abb. 25. Bitterstoffausnutzung in [%].
Die Hopfenkochzeit bzw. die Dauer der Würze-temperatur über 80 °C und die Würzezusam-mensetzung (Extraktgehalt der Würze bzw. Konzentration gelöster Stoffe).
[Quelle: Hanghofer, Gutes Bier, 2016, mod.]

Abb. 27. Bierkennzahlen auf der Rückseitenetikette eines MUG Irish Stout Bieres.
IBU-Wert dieses Irish Extra Stout beträgt 78 Einheiten. Ausgehend von der Stammwürze OG = 1.054 = 13.3 °P empfindet man das Bier als sehr herb.
Liste: Bittereinheiten bei Bieren

Abb. 26. Wahrnehmung der Bitterkeit in Abhängigkeit der Stammwürze. Lesebeispiel: in einem malzigen Bier (hoher Stamm-würzegehalt) wird ein höherer Bitteregrad weniger wahrgenommen.
[mod. nach Brücklmeier, 2018]
Abb. 30. Bierstile haben ihre spezifischen Bierfarben. [mod. aus Quelle]

3.12.3. EBC Farbstärke von Bier/Bierwürze:
Was ist Bierfarbe?
Die nüchterne Definition lautet "Die Bierfarbe wird spektralphotometrisch erfasst und dient der Klassifizierung verschiedener Bierarten. Mithilfe eines Faktors wird die Farbintensität umgerechnet und in EBC-Einheiten angegeben". Physikalisch wird also gemessen, welcher Teil des Lichtes , das von einer Lichtquelle mit bestimmter Wellenlänge ausgesandt wird, nicht absorbiert wird.
Die Bierfarbe, welche aber den Bierliebhaber erfreut und natürlich mit dem menschlichen Auge aufgenommen und im Hirn zum Gesamteindruck "spezifische Bierfarbe" verarbeitet wird (vgl. Abb. 28), der Farbeindruck bzw. die Farbwahrnehmung ist nicht identisch mit der Spektralfarbe.
Gleichbleibende Qualität und immer identische
Qualität (Konformität) sind wichtige Ziele in der
Getränkeindustrie. Die zur Charakterisierung verwendeten Bierfarbeeinheiten EBC (gemäss
EBC European Brewery Convention [Info] und MEBAK
Mitteleuropäische Brautechnische Analysen-
kommission [Info]) und SRM (gemäss ASBC American
Society of Brewing Chemists [Info]) werden in Europa
und in den USA verwendet, um die Farbe bzw. die
Farbintensität von Bier und Bierwürze zu beschreiben
EBC/ASM-Werte geben an, wieviel Licht von Bier mit
einem bestimmten Gehalt an Stammwürze absorbiert wird. Bei der jeweiligen Bierfarbe handelt es sich um Abstufungen eines Brauntons, die mit abnehmender Konzentration über Rot, kupferfarben und bernsteinfarben bis hin zu Goldgelb und Hellgelb reichen (cf. Abb. 29). Die Extinktion (= Abschwächung der Lichtstrahlung bei der Passage durch eine bestimmte "Bierstrecke") wird bei einer Wellenlänge von 430 nm gemessen
(vgl. Abb. sichtbares Spektrum hier, 430 nm = Violett-bereich [Info]). Die
übliche Formel für die Bierfarbe in EBC-Einheiten lautet, je nach der Schicht-
dicke der Messküvette ("Bierstrecke für das Licht"):
- bei 2.54 cm-Küvette 10 x Extinktion bei 430 nm = Farbe in EBC-Einheiten
- bei 1 cm-Küvette 25 x Extinktion bei 430 nm = Farbe in EBC-Einheiten
Für die SRM-Einheiten gilt:
- bei 1.27 cm-Küvette 10 x Extinktion bei 430 nm = Farbe in SRM-Einheiten
- bei 1 cm-Küvette 12.7 x Extinktion bei 430 nm = Farbe in SRM-Einheiten.
Masseinheiten: EBC, SRM, Lovibond °L
In Europa ist die EBC-Skala verbreitet, im angelsächsischen Raum die SRM-Skala und die Lovibond-Einheiten (Grad Lovibond [°L]).
Umrechnungen: SRM = EBC * 0.508, EBC = SRM * 1.97, 1 °L = 1.2 EBC. Umrechner: siehe “Color Converter”.
Methoden der Bierfarbenbestimmung
Es gibt prinzipiell zwei verschiedene Ansätze zur Bestimmung der Bierfarben:
-
spektralfotometrische Methoden:
- 1.1. Transmissionsverfahren: Licht wird durch dier Bierprobe geschickt, Lichtabsorption bei 430 Nanometer Wellenlänge, optimal in einer 10 mm
Rechteckküvette (= 1 cm3 Bier, Referenzmethode, Info, Kritik an Methode hier)
- 1.2 Reflexionsverfahren: ein Mikrospektrometer erfasst die vom Bier auf einer speziellen Oberfläche reflektieren Strahlungsanteile bei 7 verschiedenen
Wellenlängen zwischen 438 und 600 nm, bildet daraus ein Spektrum, das mit bereits hinterlegten biertyp-spezifischen SRM-Werten verglichen wird und
den ähnlichsten Biertyp konkret (z.B. Sam Adams Boston Lager) vorschlägt (Info, Video).
2. visuelle Methoden: Bierproben werden vom menschlichen Auge mit Vergleichsfarben verglichen. Im
Profi-Bierlabor erfolgt die Messung mit einem Tintometer (Info) oder einem handlichen Pocket Kolorimeter
(Info > PDF "Applikation: Bestimmung der Bierfarbe mit dem Pocket Colorimeter II (420 nm) (APP-PHM-
0005)). Vereinfachte Verfahren arbeiten mit einer standardisierten Bierfarbkarte (Info), konzipiert und
kalibriert für das Ablesen in nicht verfärbten, hochwertigen Kristallgläsern oder im offiziellen Verkostungs-
glas der Diplom-Biersommeliers (Info).
Wie bestimmt der Heimbrauer die Bierfarbe?
Eine spektrometrische Absorptionskurve gibt nicht den Farbeindruck des menschlichen Auges wieder, da
Licht von gleicher Intensität in den verschiedenen Teilen des Spektrums (cf. hier) das Auge unterschiedlich
beeinflusst; zudem ergeben sich Unterschiede beim Vergleich heller Biere mit verdünnten dunklen Bieren.
Für die Standardisierung und Qualitätssicherung in kommerziellen Brauereien ist Ansatz 1 - Spektralfotometrie -
sicher geeigneter, für den Bierliebhaber und den Heimbrauer ist die visuelle Farbkartenmethode, auch finanziell
gesehen, die Methode der Wahl.
Hier geht es direkt zur PDF-Anleitung "Bierfarbe SRM/EBC: Welche Farbstärke hat das Bier?"

Abb. 28. Die vom Auge wahrnehmbaren Bierfarben erhöhen den Reiz des Biergenusses. [Quelle]

Abb. 29. Bierfarbtafel in SRM-Einheiten. [Quelle]
SRM-Einheiten sind in den USA weit verbreitet; die Skala reicht von 1 bis 40. Der SRM-Wert 1 ist ein sehr helles Bier, der SRM-40 ist ein aussergewöhnlich dunkles Bier. Eine Zuordnung zu bestimmten Biersorten - inkl. Kritik dieser Messmethode bei 430 nm - findet sich hier und in Abb. 30.
Abb. 31. Bierfarben.
Bierfarben können mit einer standardisier-ten Bierfarbkarte bestimmt werden. [Quelle]
4. WASSERAUFBEREITUNG - Wasserprofile erfassen und designen
4.1. Welche Bierkenngrössen müssen bekannt sein
In Bearbeitung

MUG
Mikrobrauerei
seit 2012
Für Edge+Chrome+Firefox auf Notebook, Personal Computer und iPad optimiert, für Smartphones ungeeignet
18.02.2025