BRAU- und MESSTECHNIK
Brausystem, eingesetzte Messverfahren und weitere Techniken im Überblick
BRAU- und MESSTECHNIK
Brausystem, eingesetzte Messverfahren und weitere Techniken im Überblick
WASSER
Der
Körper
des Bieres
THEORIE
Chemie/Physik
Qualität
Brauwasser
Designwasser
Übersicht Untersuchungen
zur Analytik

Inhaltsverzeichnis



"Es gibt keinen Abschnitt des Brauprozesses, der nicht von den Inhaltsstoffen des Wassers beeinflusst wird". Wasser mag zwar die Hauptzutat des fertigen Bieres sein, das meiste Wasser aber verwendet der Brauer nicht für das Bier sondern für den Brauprozess selbst. [Quelle]
Neu: ab 01.01.2023 wird auch das Mischwasser der Bad Ragazer-Trinkwasserversorgung verwendet, hauptsächlich aus zwei Quellen (Gisibel [Gemeinde Tamins GR [40%, RA 3.28], Pardätsch [Gemeindegebiet Pfäfers/Vättis SG [58%, RA 4.75]) und z.T. mit beigemischtem Grundwasser (Föhrenwald [2%] RA 9.38, cf. Info), Mischwasser-RA 4.74 - 4.86.
RA: Restalkalität

Das MUG-Brauwasser kommt vom Gauschla-Alvier-Gebiet (Gemeinde Wartau SG, 2343 m, Info) und wird in der Quelle Haberbündtli (Oberschan) gefasst (Info). Sie liefert zwischen 8 - 100 Liter/s, je nach Jahreszeit. Ebenfalls aus dieser Quelle werden 9 Dorfbrunnen gespiesen wie z.B. der Brunnen beim ehemaligen Schulhaus Fontnas.
Zuletzt wird dieses von der chemischen Zusammensetzung als Brauwasser sehr geeignete weiche Wasser (Info) via Wasserhahn im Gärlabor direkt in den 20 L-Speidel-Brau-meisterkessel geleitet.
Dieses Trinkwasser wird pro Jahr amtlich ca. 6x beprobt und mikrobiologisch sowie physikalisch-chemisch untersucht (Info). Der MUG-Brauer testet bei jedem Brauansatz mindestens den pH-Wert und die elektrische Leitfähigkeit.
Stand: 04.10.2024
1. WASSER: einmalige chemisch/physikalische und biologische Eigenschaften
1.1. Wasser chemisch/physikalisch betrachtet
Eigenschaften
Trotz seiner einfachen chemischen Zusammensetzung aus nur drei Atomen Wasserstoff H und Sauerstoff O als Dihydrid des Sauerstoffs (H2O) ist das Wasser in mehrfacher Hinsicht eine aussergewöhnliche Substanz. Sein Schmelzpunkt Smp, sein Siedepunkt Sdp und der Wert für die Verdampfungswärme liegen im Vergleich zu anderen Dihydriden (H2S, H2Se, H2Te) unverhältnismässig hoch: Smp - 0.0001 °C vs. -86 °C, -66 °C, -49 °C; Sdp 99.97 °C, vs. -61 °C,/-41 °C,/-2 °C; Verdampfungswärme: 2257 kJ/kg bzw. 40,8 kJ/mol, H2S 548 kJ/kg.
Seine Wärmekapazität (Info) ist 2- 3 mal so gross wie die vieler anderer Lösungsmittel (4,184 kJ/(kg·K) (14,5 °C) , H2S: 1,004), weshalb es Temperatur-schwankungen ungleich langsamer folgt als diese. Seine hohe Dielektrizitätskonstante (Info) macht es zu einem ausgezeichneten Lösungsmittel für ionische Substanzen (z.B. Salze wie NaCl = Na+ + Cl-) und seine hohe Oberflächenspannung ist für die Ausbildung von Grenzflächen (z.B. Wasseroberfläche Teich [Wasserläufer] oder plasmatische Grenzflächen in biologischen Zellen) von grosser Bedeutung (Info). Wasser hat zudem sein Dichtemaximum nicht bei O °C, sondern bei + 4 °C, weshalb Eisschwimmt und Gewässer von oben nach unten und nicht von unten her zu frieren. Alle diese und weitere Eigen-schaften haben ihre Ursache in der Struktur des Wassers.
Struktur des Wassers
Obwohl das Wassermolekül als Ganzes elektrisch neutral ist, wirkt es als sog.
Dipol (Abb. 1): Sauerstoff O hat die grössere Anziehungskraft auf die Bindungs-
elektronen (= grössere Elektronegativität, Info) und zieht die beiden Bindungen
zwischen O und H mit je zwei Bindungselektronen näher zu sich heran. Dadurch
entstehen zwei Ladungsschwerpunkte, negativ beim O-Atom, positiv bei den
H-Atomen. Dadurch ziehen sich die Wassermoleküle gegenseitig über sog.
Wasserstoffbrücken (H-Brücken) an und bilden 3-dimensonal vernetzte Strukturen
(= Cluster), mit dazwischen frei beweglichen Wassermolekülen (= flüssiger Zustand,
Abb. 2). Im Eis sind die Strukturen fest aneinander gebunden, im Dampf sind die
einzelnen Wassermoleküle frei beweglich. Die 3 Zustände Eis <--> flüssig <--> gas-
förmig (Dampf) sind abhängig von der äusseren Energiezufuhr: je höher diese ist,
desto beweglicher sind die Wassermoleküle, d.h. sie besitzen dann eine höhere
kinetische Energie (Bewegungsenergie).
Wasserhüllen um Salzteilchen
Sind Ionen z.B. aus Salzen wie Kochsalz NaCl (= Na+Cl-) gelöst, so üben sie infolge
ihrer elektrischen Ladung Na+ bzw. Cl- eine Anziehungskraft auf die Wasserdipole
aus und umgeben sich mit einer Wasserhülle, in der je nach Ladungssinn entweder
die positiven oder negativen Pole der Wassermoleküle den Ionen zugekehrt sind
(Abb. 3). Dieser Vorgang wird als Hydratation bezeichnet (Info1, Info2). Auch
elektrisch neutrale Teilchen können Hydrathüllen ausbilden, wenn sie eine un-
gleichmässige Ladungsverteilung aufweisen (z.B. viele Proteine).
Wasser als Lösungsmittel für viele Stoffe so aneinander.
Auflösen bedeutet, dass ein Feststoff in seine kleinsten Teilchen zerlegt wird
und diese sich darauf im Wasser gleichmässig verteilen. Je nach ihren Eigen-
schaften können sich die Teilchen bestimmter Stoffe sehr gut, andere schlecht
oder gar nicht unter die Wasserteilchen mischen.
Zu den Stoffen, die sich sehr gut in Wasser lösen, gehören die Salze. Im Vergleich
zu anderen Flüssigkeiten ist Wasser sogar eines der besten Lösungsmittel für
salzartige Verbindungen. Im festen Salz ordnen sich die positiven und negativen
Ionen abwechselnd an, sodass sich ein dreidimensionales Gitter ergibt – das
Ionengitter (Abb. 3). Kochsalz (= Natriumchlorid) besteht aus positiv geladenen
Natrium-Ionen und einem negativ geladenen Chlorid-Ion. Diese ziehen sich gegen-
seitig an. Wenn man nun Kochsalz in Wasser gibt, passiert Folgendes:
-
Die positiven und negativen Ionen lösen sich aus ihrer Gitterstruktur und sind
im Wasser frei beweglich.
-
Die Wassermoleküle umlagern das positive Natrium-Ion so, dass das schwach
negativ geladene Sauerstoffatom zum positiven Natrium-Ion zeigt.
-
Das negative Chlorid-Ion hingegen wird von den Wassersmolekülen so umlagert,
dass die schwach positiv geladenen Wasserstoffatome zu ihm zeigen.
-
Die Anlagerung der Wassermoleküle an gelöste Ionen nennt man "Hydratation"; es bilden sich "Wasserschwärme" oder Cluster.
-
Die nun von den Wassermolekülen umschlossenen Ionen lösen sich im Wasser auf.
-
Diese Lösungsvorgänge sind stark temperaturabhängig.
Aber auch von gut löslichen Substanzen kann das Wasser immer nur eine begrenzte Menge aufnehmen. Ab einer gewissen Konzentration, die je nach Stoff unterschiedlich ist, löst sich bei weiterer Zugabe nichts mehr auf, die überschüssige Substanz bleibt als fester Bodensatz zurück. Man sagt dann, die Lösung ist gesättigt. Fette und Öle, die eine grosse Molekülstruktur haben (-H-C-Ketten) oder nicht geladen sind, werden vom Wasser abgestossen (hydrophob: Info).
Weil Wasser so ein gutes Lösungsmittel ist, ist in der Natur vorkommendes Wasser nie chemisch gesehen völlig rein, sondern enthält immer gelöste Stoffe: Salze aus dem Gestein und Gase aus der Luft. Meerwasser enthält besonders viele gelöste Salze. Doch auch in Leitungswasser sind feste Stoffe gelöst. Wenn man einen Tropfen davon auf einer Glasplatte verdunsten lässt, bleiben die gelösten Stoffe als fester Belag zurück.



Abb. 1. Wassermoleküle bilden infolge ihres
Dipol-Charakters schwache Bindungskräfte
zwischen den H2O-Molekülen (= Wasserstoff-
brücken) und "kleben" so aneinander.
Abb. 2. Wasserdipole bilden 3-dimensional vernetzte Strukturen
(= Cluster: eingekreist); dazwischen können sich die Wassermoleküle frei bewegen
[Quelle: Nultsch, Allg. Botanik,
11. Aufl. (2001), S. 45].
Abb. 3. Lösungsvorgang.
Lösungen sind Mischungen von Molekülen und/ oder Ionen (geladenen Teil-chen). Beim Lösen von Salzen umgeben polare Wassermoleküle die Anionen (= negativ geladen, Cl-) und Kationen (= positiv geladene Ionen, Na+).

Abb. 4. Wassergehalt von Organismen.
Beim Menschen beträgt der H2O-Gehalt zwischen 60-80% [Info], bei Bakterien etwa 80% [Info], in Hefezellen ca. 70-80%, Brauhefen 76.5% [Info]. [Quelle Abb. 4: unbekannt]
1.2. Wasser in lebenden Zellen und bedeutende Eigenschaften für kleine Organismen
Wasser in lebenden Zellen als ideales Lösungsmittel für den Stoffwechsel
Leben und damit verknüpft die physiologisch-biochemischen Lebensprozesse sind
ohne Wasser nicht möglich. Alle Lebewesen bestehen zu einem Grossteil aus Wasser
(Abb. 4). Die ständig in den Zellen ablaufenden Reaktionen des Stoffwechsels sind
auf ein wässriges Milieu angewiesen: Makromoleküle wie Eiweisse und alle anderen
Moleküle in Zellen wie z.B. Maltose (Malzzucker) als ein wichtiger Ausgangsstoff der
Gärung schwimmen im Wasser.
Wasser ist ein ideales Lösungsmittel der Zellkomponenten und das Transportmittel
für die gelösten Stoffe. Wasser ist besonders wichtig für die räumliche Struktur der
Proteine, da es Wasserstoffbrücken (Abb. 1) mit Atomen eines Proteins und Wasser-
hüllen um die Eiweisse bildet. Wasser kann zusätzlich ein Ausgangs- oder Endprodukt
von biochemischen Reaktionen sein.
Wasser im Innern der Zelle übt zudem einen Druckauf die Zellwand aus und verleiht
Pflanzen sowie Bakterien und Hefen Festigkeit und Form.
Infoquellen Wasser: Didaktik Chemie Uni Bayreuth Chemie.de Tabelle
2. WASSER GRUNDWISSEN: Kurzcharakterisierung der physikalisch-chemischen Kenngrössen
2.1. Brauwasser - die entscheidenden Kenngrössen physikalisch-chemischer Natur
Vorbemerkung: Wasserchemie und Wasseranalytik sind nicht ganz trivial. Wer einfach "sein" Trinkwasser ab Wasserhahn nimmt und Biere braut, bekommt meistens ein gutes Bier. Wer aber sein Bier auf die Stufe "excellent" anheben oder einen ganz bestimmten authentischen Stil nachahmen möchte, der muss sich mit dem Wasser vertieft auseinander setzen und u.U. sein Brauwasser aufbereiten oder sogar "designen". Das Wasser nicht einfach reines H2O ist, muss man sich mit etwas Chemie und den wichtigsten braurelevanten gelösten Stoffen und deren Auswirkungen auf den Brauprozess befassen.
Um Brauwasser zu verstehen und, falls notwendig, auch aufbereiten zu können, sollte man deshalb 1. Wasseranalysen (z.B. des Wasserversorgers) lesen und interpretieren können (Bsp. DKGF-Fontnas, Info), 2. ein geeignetes Wasserprofil für den gewünschten Bierstil ermitteln und 3. geeignete Aufbereitungs-verfahren kennen und anwenden können. Dazu ist allerdings auch ein gewisses Mass an chemisch-physikalischem Grundlagenwissen notwendig. Denn "Es gibt keinen Abschnitt des Brauprozesses, der nicht von den Inhaltsstoffen des Wassers beeinflusst wird" (K. Glas, TU München, Leiter Arbeitsgruppe "Wassertechnologie", 2018 [cf. hier]).
Folgende physikalisch-chemischen Wassereigenschaften stehen im Fokus des Bierbrauers (* Schlüsselparameter):
-
Temperatur* - beeinflusst alle physiologisch-biochemischen Prozesse, insbesondere Enzyme (Temperaturoptimum) und dadurch ganze Organismen wie Hefen --> zur Methode Temperaturbestimmung
2. pH-Wert* - Mass für den Säuregrad des Wassers bzw. einer wässrigen Lösung --> zur Methode pH-Bestimmung
3. Wasserhärte (Gesamthärte) - Summe aller Calcium- und Magnesiumverbindungen --> zur Methode Härtebestimmung
4. Karbonathärte KH (Säurekapazität, syn. Säurebindungsvermögen "SBV", Alkalinität, Gesamtalkalität) - Ca2+ und Mg2+-Kationen (= positiv geladene
Ionen), die an die negativen Hydrogencarbonationen HCO3- (= Anionen) gebunden sind --> zur Methode Karbonathärtebestimmung
5. Nichtkarbonathärte NKH - Mineralsäurehärte, Ca2+- und Mg2+-Ionen gebunden an andere Anionen wie Chloride Cl-und Sulfate SO4 2-
--> zur Methode NKH-Bestimmung
6. Calcium- und Magnesiumionen - Ca2+ und Mg2+ Hauptplayer unter den Kationen, sowohl für Gesamthärte als auch
für die entscheidende Restalkalinität -- --> zur Methode Calcium-Magnesiumhärte
7. Restalkalität* - neben pH-Wert und Temperatur die Kardinalgrösse für das Brauwasser --> zur Methode Restalkalität
8. Wasserinhaltsstoffe wie Alkaliionen Na+ und K+, Chlor/Chlorid Cl-, Sulfat SO4 2-, Nitrationen NO3-, Eisenionen
--> zu den Methoden weitere Wasserinhaltsstoffe
Umfassender Überblick Testsysteme zur Wasseranalytik: MerckMillipore hier, und MN Macherey-Nagel hier.
Weitere interessante und aussagekräftige Wasserparameter sind
9. elektrische Leitfähigkeit --> zur Methode Leitfähigkeits-/TDS-Bestimmung
10. gelöster Sauerstoffgehalt O2 --> zur Methode Sauerstoffgehalts-Bestimmung (inkl. Vermeidung von O2-Eintrag)
Keine physikalisch-chemischen Wasserparameter, aber ebenfalls wichtig sind die
11. mikrobiologischen Kenngrössen - insbesondere die "Gesamtkeimzahl" ( = aerobe mesophile koloniebildende
Einheiten [KBE] --> zur Methode Gesamtkeimzahl - KBE aerober mesophiler Keime
Weitere wichtige bzw. wünschenswerte Analysen für das Braulabor:
12.1. Stärkenachweis --> zur Methode Iodprobe (qualitativer Stärkenachweis beim Maischen)
12.2. IBU International Bitter Units --> zur Methode International Bitter Units
12.3. Farbstärke EBC/SRM von Bier/Bierwürze --> zur Methode Bestimmung der Bierfarbe SRM/EBC
In den folgenden Kapiteln zum "Wasser Grundwissen" wird die Basis zum Verständnis dieser Wasserkenngrössen gelegt. Die praktischen Anleitungen sind auf der Seite "Physikalisch-chemisches Braulabor" zu finden (cf. hier).
2.2. Kenngrösse 1: Die TEMPERATUR - ein Schlüsselparameter
2.2.1. Die Temperatur beeinflusst primär Enzymaktivitäten
Die Temperatur hat einen ganz entscheidenden Einfluss auf den gesamten Stoffwechsel. Der
Stoffwechsel läuft nur in relativ engen Temperaturbereichen optimal ab. Eine Temperaturerhöhung
steigert die Geschwindigkeit einer enzymatischen Reaktion. Dafür ist die beschleunigte Bewegung
der Moleküle in wässriger Lösung verantwortlich (Brownsche Molekularbewegung): sie führt zu einem
häufigeren und heftigeren Zusammentreffen der Reaktionspartner, z.B. Enzym und Substrat (= Stoff
[passender Schlüssel], den das Enzym "kennt" [Schlüsselloch]). Enzyme haben also ein Temperatur-
optimum (z.B. stärkespaltende Amylasen in Maische: Maltose-abspaltende β-Amylase 60-65 °C,
Oligosaccharide [6-7 Glukose-Einheiten] u.a.-abspaltende α-Amylase 70-75 °C, Maltose in Glukose-
spaltende Maltase 35-40 °C).
Enzyme sind Eiweisse, also höchst komplexe Strukturen, deren räumliche Struktur entscheidend für deren
tadelloses Funktionieren ist. Beim Übersteigen einer bestimmten kritischen Temperaturgrenze kommt es
zur Denaturierung des Proteins, also einer Verformung bis Zerstörung der Struktur und damit zu einem
steilen Abfall der Enzymaktivität (vgl. Abb. 5). Jedes Enzym besitzt ein spezifisches Temperaturoptimum.
2.2.2. Einfluss der Temperatur während verschiedener Phasen im Brauprozess
Die Temperatur spielt eine ganz entschiedende Rolle während des Maischens (--> Maischprogramme: 3-Rasten-Maischprogramm, 4-Rasten-Maisch-programm [= Grundprogramm] vgl. Abb. 6, während der Hauptgärung. Aber auch bei den übrigen Prozessphasen ist immer auf die Temperatur zu achten, so bei der Nachgärung, der Reifung und der Lagerung.
1. Maischen: typische Maischprogramme
Drei-Rasten-Maischprogramm: Vier-Rasten-Maischprogramm:
Eiweissrast: 20 min bei 50 °C Einmaischrast: 10 min-2.5 Std. 38 °C
β-Amylaserast: 30 min bei 65 °C Eiweissrast: 10 - 30 min 50-53 °C
α-Amylaserast: 30 min bei 72 °C β-Amylaserast: 20 - 60 min 62-67 °C
Abmaischen: bei 78 °C α-Amylaserast: 20 - 60 min 72 °C
Abmaischen bei 78 °C
Die Bedeutung der Temperatur für den gesamten Brauprozess und
insbesondere für die Hauptgärung kann nicht genug betont werden!
(vgl. Seite "Mikrobiologisches Braulabor II > Braulabor 24: Wie überwacht und
regelt man den Gärprozess?" (hier).
Abb. 6. Einfluss der Temperatur auf die Maischeenzyme. Tabelle dazu hier.
[Quelle Abb. 6: Lehrl, Bier brauen, 2008]

Vier-Rasten-Maischprogramm für Lagerbiere:
Einmaischrast: 20 min 38 °C
Eiweissrast: 10 - 30 min 44-59 °C
β-Amylaserast: 20 - 60 min 60-66 °C
α-Amylaserast: 20 - 60 min 68-74 °C
Abmaischen bei 76-78 °C

2. Anstellen, Hauptgärung, Nachgärung und Kaltlagerung (Klärung, Reifung):
Bsp. ALE-Hefen (obergärig)
Um die Bildung von Fehlaromen zu verhindern, empfiehlt es sich, den
folgenden Temperaturverlauf für das Anstellen und die anschliessende
Hauptgärung zu berücksichtigen (Abb. 7):
-
1. Phase: ca. 1 Tag - Anstelltemperatur 1-1.5 °C tiefer als die
empfohlene optimale Hefestammtemperatur (cf. "Mikrobiologisches
Braulabor, Handlingtipp Nr. 5 Wahl der Brauhefen, cf. hier), meist
um 18-19°C
-
2. Phase: Hauptgärung - Gärtemperatur von z.B. 19 °C auf 20 °C
anheben und dann konstant halten (Temperatur Faustregel:
18-21 °C)
-
3. Phase: Ende Hauptgärung, Diacetylrastphase - Gärtemperatur
um 1 °C anheben z.B. auf 21 °C, ca. 4-8 Tage belassen.
-
4. Phase: Nachgärung (Flaschengärung, Karbonisierung durch
Speise- oder Zuckerzugabe): 21-27 °C, Dauer ca. 2 Wochen
-
5. Phase: Kaltlagerzeit, Klärung und Reifung - kühl lagern bei ca.
4-12 °C, Lagerzeitwerte je nach Biersorte und Stammwürze:
Weizenbiere 4-6 Wochen, helle Starkbiere (je nach Hopfung 8-10
Wochen [schwach], 10-12 Wochen [stark]), Fest- und Märzenbiere
6-8 Wochen, dunkle Biere: kürzer lagern als helle Biere.
Wichtiger Hinweis: die Gärung ist exotherm, d.h. sie produziert
Wärme. Wird "nur" die Umgebungstemperatur konstant gehalten, ist
die Temperatur im Innern des Gärbehälters i.d.R. deutlich höher!
Konsequenz: die Messung sollte optimal im Innern des Gärtanks erfolgen.
Abb. 7. Empfohlener Temperaturverlauf beim Anstellen von obergärigen ALE-Hefen ("pitch yeast"), während der Hauptgärung ("fermentation") und der Schlussphase der Primärgärung (Diacetylrast, "condition").

Bsp. LAGER-Hefen (untergärig) Abb. 8
-
1. Phase: ca. 1 Tag - Anstelltemperatur 1-2 °C tiefer als die empfohlene optimale Hefestammtemperatur, also um ca. 8-11 °C
-
2. Phase: Hauptgärung - Gärtemperatur zwischen 10-13 °C* konstant halten (*bzw. je nach Empfehlung des Hefeproduzenten für den jeweiligen Hefestamm, cf. "Mikrobiologisches Braulabor, Handlingtipp Nr. 5 Wahl der Brauhefen, cf. hier; weitere Empfehlungen 12-17 °C
(Carpenter, D., Lager. The definitive Guide to tasting and brewing the world's most popular beer styles. Quarto Publ. Group, Minneapolis (2017), S. 189]
-
3. Phase: Ende Hauptgärung, Diacetylrastphase (nach ca. 3-5 Tagen = nach 2/3 erfolgter Gärung gemäss SG-Messungen (specific gravity, relative Dichte [vgl. "Mikrobiologisches Braulabor II - Braulabor 29 Bestimmung der Dichte (Extraktgehalt) von Stamm- und Gärwürzen mit verschiedensten Verfahren", cf. hier] - Gärtemperatur um 5-10 °C anheben (aber nur mit 5 °C pro Tag) z.B. auf 18-20 °C, ca. 6-12 Tage belassen
-
4. Phase: Kaltlagerung - Temperatur langsam absenken um max. 5-6 °C pro Tag bis auf 2 °C, Dauer: 1-2 Wochen
-
5. Phase: Nachgärung (Flaschengärung, Karbonisierung durch Speise- oder Zuckerzugabe) - erneute Hefezugabe des gleichen Hefestammes, aber weniger als bei der Anstellung (z.B. max. 1 Trockenhefebeutel, rehydriert); die Karbonisierung sollte bei Raumtemperaturen zwischen 18-24 °C erfolgen
-
6. Phase: Schlusslagerung - bei kühler Kellertemperatur um 10-15 °C
oder für bessere Haltbarkeit kalt im Kühlschrank bei Temperaturen
um 8-12 °C.
-
7. Phase: Kaltlagerung - Bier langsam um ca. 1 °C pro Tag auf 5-8 °C
abkühlen. Lagerzeitwerte: Pils- und Lagerbiere 4-6 Wochen, Export-
biere 5-6 Wochen.
Hinweis: falls eine Starterkultur notwendig ist, sollte sie bei Temperaturen
nicht höher als 3-5 °C über der beabsichtigen Gärungstemperatur sein
(Dauer: 1-2 Tage)!
Abb. 8. Lager-Hefen: Temperaturgesteuerter Fermentationsverlauf
[Quelle: Carpenter, 2017, mod.].
2.2.3. Messung der Temperatur im Bierlabor
Die Bestimmung der Temperatur wird im deutschsprachigen Raum mit der Celsiusskala
durchgeführt (Fixpunkt 1: Gefrierpunkt Wasser 0 °C, Fixpunkt 2: Siedepunkt des Wassers
100 °C), während im US-Raum die Fahrenheitskala am häufigsten eingesetzt wird
(Fixpunkte: Gefrierpunkt = 32 °F, Siedepunkt Wassers = 212 °F; Umrechnungs-
In der Braupraxis werden hauptsächlich zwei Arten von Thermometern eingesetzt:
Flüssigkeitsthermometer (Abb. 9, Nr. 1-4)
Flüssigkeiten dehnen sich beim Erwärmen aus. Als Flüssigkeiten werden verwendet:
- Quecksilber: sehr gute Wärmeleitfähigkeit, praktisch lineare Ausdehnung, von -36 - ca.
360 °C einsetzbar, aber hochgiftiges Material (--> Gefährdung bei Bruch durch
Quecksilberdämpfe. Daher ist der einzige Verwendungszweck der Einsatz als
"Vergleichsthermometer" zur Kontrolle der übrigen Thermometer. Sicherheitsinfo:
siehe hier (1. Abschnitt "Flüssigkeitsthermometer, unten beachten!).
- Organische Flüssigkeitsthermometer: es werden farblose Alkohole und Siliconöle
eingesetzt, die zur besseren Ablesbarkeit eingefärbt werden.
Flüssigkeiten: Toluol (ca. -70 °C bis ca. 110 °C), Alkohol (Ethanol, ca. -110 °C bis ca. 60 °C),
modifizierte Siliconöle, Glycerin u.a. Im Gegensatz zu Quecksilber benetzten diese
Flüssigkeiten Glas und sind daher ungenauer. Beispiele: Info1, Info2.
Elektronische Digital-Thermometer (Abb. 9, Nr. 5,6)
Heute werden meist elektronische Digitalthermometer eingesetzt. Elektronische Thermometer
können als
- Widerstands-Thermometer (Messfühler mit metallischem Leiter als elektrischen Widerstand,
der mit Zunahme der Temperatur steigt, PTC-Fühler) funktionieren
- häufig sind sie mit Temperatur-Messfühlern mit einem Thermoelement aus zwei verschiedenen
Metallen (z.B. Kupfer und Konstantan mit einer Kupfer-Nickel-Legierung) versehen; erwärmt
man die Kontaktstelle, entsteht eine Spannung (sog. Seebeck-Effekt).
- daneben gibt es auch noch die berührungslosen Thermometer (Pyrometer, Strahlungsthermo-
meter, IR (Infrarot)-Thermometer [Info]).
Beispiele: Info1, Info2 > Bierherstellung > Messinstrumente > Thermometer, Info3.
Detaillierte Anleitungen zur Messung der Temperatur sind auf der Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier, Anleitung als PDF-Dokument hier).
Abb. 9. Temperaturmessung von Flüssigkeiten (Nr. 1-5) und Oberflächen (Nr. 5, 6).
Links: Flüssigkeitsthermometer
1: Präzisions-Vergleichsthermometer 0-100°C, 0.5°C
(zur "Eichung" der übrigen Thermometer).
2: Brauthermometer (gelb) -20-110°C, 1°C.
3: Laborthermometer -10-110°C, 1.0°C
4: Laborthermometer -30-50°C, 1.0°C.
Mitte: 5 elektronisches Digitalthermometer, -50-300°C, 0.1°C.
Rechts: 6 Infrarot-Thermometer -30-260°C, 0.1°C.
2.3. Kenngrösse 2: Der pH-WERT - ein Schlüsselparameter
2.3.1. pH-Wert oder der "Säuregrad" des Wassers Info
Der pH-Wert einer wässrigen Flüssigkeit ist ein Mass für den Säuregrad.
Wasser besteht aus H2O-Molekülen, wobei ein ganz kleiner Anteil immer
als Ionen vorliegen gemäss der Reaktionsgleichung: H2O <--> H+ + OH-
(genauer: H2O + H2O <--> H3O+ + OH-). Das positiv geladene Wasser-
stoffion oder Proton H+ (das als H+ + H2O --> H3O+ als Oxoniumion
vorliegt), hat einen sauren Charakter (Info), während das negativ geladene
OH- Hydroxidion basisch (= alkalisch) wirkt (Info).
Der pH-Wert ist eine logarithmische Zahl zur Kennzeichnung der Wasser
stoffionenkonzentration [H+] in einer wässrigen Lösung und zeigt an, ob
H+-Ionen oder OH- -Ionen vorherrschen, ob also die Lösung sauer oder
basisch (bzw. alkalisch) ist (Abb. 10, 11).
Säuren und Basen beinflussen den pH-Wert, indem
-
Säuren wie z.B. Salzsäure HCl, Phosphorsäure H3PO4 oder Milchsäure
C3H6O3 als Protonenspender H+ (in Wasser sofort H+ + H2O --> H3O+)
die H+-Konzentration erhöhen und dadurch den pH-Wert absenken.
-
Basen (auch Laugen genannt) wie z.B. Natronlauge NaOH, Ammoniak
und auch Salzverbindungen reagieren durch Entnahme von Protonen
H+, erniedrigen dadurch die H+-Konzentration und erhöhen somit den
pH-Wert. Basen als Protonenfänger erreichen dies auf verschiedene
Weisen:
- Natronlauge: NaOH in H2O --> gibt OH- ab, das mit Protonen reagiert:
OH- + H+ --> H2O
- Ammoniak NH3: NH3 + H2O --> NH4+ + OH-
OH- + H+ --> H2O
- Natriumhydrogenkarbonat NaHCO3: beim Lösen im Wasser bilden
die Hydrogencarbonat-Ionen teilweise Hydroxid-Ionen OH-:
HCO3- + H2O --> H2O + CO2 + OH-
OH- + H+ --> H2O
und senken somit die H+-Konzentration, was einen höheren pH-Wert bedeutet.
Abb. 10. pH-Wert zwischen stark sauer (= pH 0-1), neutral (pH 7) und stark basisch/alkalisch mit pH 14.
Der pH-Wert spielt im Alltag des Menschen, aber vor allem auch im Körper eine ganz wichtige Rolle: die Enzyme als Stoffwechselkatalysatoren sind ganz stark pH-abhängig. So sind es auch die Maischeenzyme, die ein pH-Optimum von 5.4 bis 5.8 besitzen.
Die pH-Skala reicht von 0-7 (= stark sauer - schwach sauer), 7 (= neutral) und 7-14 (schwach bis ganz stark basisch bzw. alkalisch). Die Skala ist logarithmisch, d.h. z.B. pH 5 ist 10x saurer als pH 6, Milch mit pH 6 ist 100x schwächer sauer als Coca Cola mit pH 4, und pH 8 ist 10x schwächer basisch als pH 9.
Hinweis: Das Kürzel pH stammt aus dem Lateinischen "potentia hydrogenii", was "Konzentration der Wasserstoff-Ionen" H+ bzw. H3O+ bedeutet.

Abb. 11. Der pH-Wert als Mass für den Säuregrad einer wässrigen Lösung.
Der pH-Wert entspricht einer Protonenkonzentration und wird als negativer Zehnerlogarithmus angegeben.
Die Zahlenangabe von 0 bis 14 kommt zustande, weil in sauren, neutralen und basischen Lösungen das Produkt aus Protonenkonzentration [H+] und Hydroxidionenkonzentration [OH-] konstant ist, immer 10^-14 mol/L. (Info mol/ Video)
2.3.2. pH-Wert in Zellen/Lebewesen
Der Stoffwechsel als Grundlage allen Lebens auf der Stufe einer Einzelzelle wie Hefe oder in mehrzelligen Lebewesen wie Mensch ist letztlich ein komplexes Wechselspiel zwischen Substratmolekülen und Enzymen, den biologischen Stoffwechselrealisatoren. Sie ermöglichen Art und Richtung eines Stoffwechselweges bei Zell-/Körpertemperaturen, indem sie spezifisch Moleküle erkennen, die Reaktionen massiv beschleunigen (Biokatalysatoren!). Sie arbeiten aber nur optimal in einem relativen engen pH-Bereich, d.h. der pH-Wert bestimmt die Aktivität von Enzymen (Info).
Beispiele:
- Blut des Menschen: pH 7.4/ Verdauungsenzym (Proteine abbauend) Pepsin im Magen: pH 2 - 3/ Protein spaltendes Trypsin im Dünndarm: pH 7-8
- stärkeabbauende Amylasen: pH 3.5 - 9, Beta-Amylase pH 5.2 (Info1, Info 2)
- "Maischeenzyme": pH 5.2 - 5.4 (helle Biere), pH 5.4 - 5.6 (dunkle Biere) (Info; ausführliche Tabelle hier)
- Mikroorganismen: Bakterien neutrales bis schwach alkalisches Medium (pH 6 - 8.5); Milchsäurebakterien (Lactobacillen) schwach saurere Bereich (pH 5 -
6.5); Hefen pH 5 - 6.5.
2.3.3. Säuren und Basen im Alltag Abb. 12
Neben der grosse Bedeutung in vielen industriellen Produktionsprozessen und im Umweltschutz sind Säuren und
Basen auch im täglichen Leben ständig präsent. Beispiele: Wasch- und Reinigungsmittel, Baustoffe, in vielen
Lebensmitteln wie z.B. Getränke, Milchprodukte, Citronensäure, Essig u.v.m.
-
Reinigungsmittel: Säuren sind in Kalkentfernern für z.B. Kaffeemaschinen und sanitären Anlagen enthalten.
Schwache Basen setzt man zur Bodenreinigung, Fett- und Ölentfernung ein, während starke Basen zur
Grundreinigung bei starker Verschmutzung angewendet werden.
Rohrreiniger: Wirkung beruht auf der ätzenden Wirkung von Natriumhydroxid NaOH, da Rohrverstopfungen
meist organischer Natur sind (z.B. Haare).
-
Seifen: sind die ältesten bekannten Waschmittel (Kernseife/Schmierseife: Gemisch aus langkettigen Fettsäuren
plus Natriumsalze/bzw. Kaliumsalze). Wässrige Lösungen von Seifen reagieren alkalisch, da bei der Hydrolyse
die Salze zu wasserunlöslichen Fettsäuren und Hydoxiden reagieren:
C15H31COONa + H2O --> C15H31COOH + NaOH --> Seifenlaugen brennen in den Augen, zerstören zudem
die Säureschutzschicht der Haut (Info)
-
Lebens-/Genussmittel: Essig enthält Essigsäure (z.B. Essiggurken, Salatessig), Milch mit Milchsäure, auch in
Getränken wie z.B. Rivella (Info); Phosphorsäure und Kohlensäure ist in Coca Cola zu finden (Info), Kohlensäure
ist in vielen Mineralwässern zugegeben und kann auch selber ins Trinkwasser eingepresst werden (Trinkwasser-
sprudler, Info); der Bäcker bestreicht die Brezel vor dem Backen mit einer verdünnten Natronlauge --> nach dem
Backen leicht bitterer Geschmack.
Info zu Laugen, Info zu Säuren im Alltag, sehr illustrative Grafik dazu!
Abb. 12. Typische pH-Werte von Alltagsflüssigkeiten. [Quelle]
2.3.4. pH-Wert und Brauprozesse Abb. 13
Überblick
Neben der Temperatur ist zweifelsohne der pH-Wert ein zweiter ganz entscheidender Parameter im gesamten Brauprozess, vom Wasser über den Maischeprozess bis hin zum reifenden Bier: 1 Brauwasser/Brauwasserbehandlungen, 2 Enzyme des Maischeverfahrens (cf. unten, Tab. hier), 3 Bierwürzen/ Anstellwürze, 4 Fermentation/Gärlösungen, 5 Hefe-Flokkulation, 6 Anzuchtlösungen für Bakterien (Milchsäurebakterien)/Bierhefen, 7 Reifung und Lagerung der Biere.
Maischeprozess
Der Haupteinfluss des pH-Wertes, abgesehen von der Wasserchemie (z.B. Wasserhärte, Säurekapazität u.a.) ist die Beeinflussung der Enzymaktivitäten innerhalb der Zellen (Hefe-/Bakterienzellen) als auch ausserhalb, z.B. auf die vielen während der Maische aktiven Enzyme. Dazu gehören
-
der Abbau von Stärke durch Malzamylasen: α-Amylase [Amylose, Amylopektin]–> Oligosaccharide, hochmolekulare Dextrine, Dextrine, Maltotriose, Maltose,Glucose, Fructose (pH-Optimum 5.6-5.8, Temp.optimum 70-74 °C), β-Amylasen [α-Glucane] –> Maltose, Glucose, Maltotriose (pH-Optimum 5.4-5.6, Temperaturoptimum 61-63 °C), Maltasen [Maltose] –> Glucose (pH 6.0, Temp.optimum 35-40 °C), Grenzdextrinasen [Grenzdextrine] –> Dextrine (pH 5.1, Temp.optimum 60-62.5/67 °C), Saccharase [Saccharose] –> Glucose, Fructose (pH 5.5, Temp.optimum 50 °C).
-
der Abbau von ungelösten *β-Glucanen: durch 4 verschiedene Glucanasen (Temp. Optima 40-48 °C, 60 °C, 50-70 °C; pH 3.5-6.5, Optimum 5.5) wird das feste Zellwandgerüst abgebaut (= sog. Lösung, Auflösung, auch Cytolyse genannt) und so können die übrigen Enzyme ins Endosperm (= Mehlkörper) gelangen und ihre Abbauaktivitäten aufnehmen.
-
der Abbau von Eiweissstoffen: durch 4 verschiedene proteolytische Enzyme (Endo- [pH 4.0, Temp. 40-50 °C], Carboxy- [pH 5.2, Temp. 50-60 °C], Amino- [pH 7.2, Temp. 40-45 °C] und Dipeptidasen [pH 8.2, Temp. 40-45 °C]) bei Temperaturen zwischen 45-50 °C.
-
die Umwandlung von Fettsäuren: durch fettabbauende Lipasen und Lipoxygenasen –> Fettsäuren, Hydroxyfettsäuren, Glycerin.
-
Weitere Abbauvorgänge: führen zur Freisetzung von Phosphaten, Polyphenole, Zink und sind z.T. pH-abhängig (z.B. niedriger pH-Wert fördert Zn-Freisetzung). Das Zusammenwirken der pH-wirksamen Calcium- und Magnesium-Wassersalze mit den Phosphaten u.a. stellt sich ein Maische-pH-Wert von ca. 5.6-5.8 ein; wünschenswert ist allerdings ein Maische-pH-Mischwert von ca. 5.2 - 5.4 - 5.5.
Auswirkung eines optimierten pH-Wertes auf die Maische:
- effizientere und ergiebigere enzymatische Prozesse und dadurch auch raschere
Verzuckerung
- positive Effekte auf den Eiweissabbau (--> FAN Hefenahrung: freier Aminostickstoff
für Hefewachstum
- besserer Glucanabbau
- besseres Abläutern
Zusatzinfo: *Beta-Glucane (β-Glucane) sind eine Gruppe von hochmolekularen,
linear verzweigten β-D-Glucose-Polysacchariden, welche in den Zellwänden von
Getreide, Bakterien und Pilzen vorkommen. Der Abbau von Zellwänden während
des Maischeprozesses ist wichtig, damit es nicht zu Läuterproblemen (Viskositäts-
erhöhung) kommt. Info (Malzanalyse, Proteolyse, Cytolyse).

Abb. 13. Der pH-Wert von der Maische bis zum fertigen Bier.
[Quelle: Palmer/Mills, 2014, mod.]
Läutern und Hopfen
Nachdem die Stärke im Malz ausreichend in Zucker umgewandelt wurde, wird die Bierwürze abgetrennt. Der pH-Wert und die Temperatur der Würze sind entscheidend für die gewünschte Denaturierung und die Fällung der Eiweisse. Der pH-Wert wird vor der Zugabe des Hopfens (Dolden, Extrakt oder Pellets) kontrolliert und gegebenenfalls angepasst. Die Zusammensetzung der aus dem Hopfen extrahierten Bitterstoffe ist stark pH-abhängig. Wenn auch die Gesamtmenge der Bitterstoffe bei höherem pH-Wert grösser wäre, ist der Geschmack besser ausgewogen sofern der pH-Wert für die Zugabe des Hopfen niedriger gehalten wird. Der pH-Wert bestimmt so zusammen mit der Hopfenmenge, der Temperatur und der Kochzeit in der Würzepfanne wie herb das Bier wird. [Quelle: Zuzana, Hanna-Instruments, 31.01.2018]
Würzelösung
Der optimale pH-Wert beträgt 5.0 - 5.5.
Auswirkungen:
- bessere Proteinausfällung
- dadurch bessere FAN-Ausstattung
- bleichere Würzefarbe und geringere Isomerisierung der unlöslichen Hopfen- α-Säuren
Gärung (Fermentation)
Nach dem Abkühlen der Würze wird diese mit Sauerstoff gesättigt und mit Bierhefe-Reinkulturen geimpft. Während der Gärung fällt der pH-Wert meist Werte um 4.1 bis 4.3. Niedrigere pH-Werte (3.4 - 3.7) können auf eine bakterielle Kontamination hindeuten. Wiederum höhere pH-Werte um 4.6 - 4.9 können ein Zeichen der unerwünschten Autolyse der Hefezellen sein. Auch gesunde Hefe kann bei zu hoher Temperatur unerwünschte Nebenprodukte herstellen die einer geschmacklichen Beeinträchtigung führen. Dementsprechend wichtig ist es, die Gärung bei einer niedrigen Temperatur durchzuführen und regelmässig auch den pH-Wert zu kontrollieren.
Der optimale pH-Wert beträgt 5.1 - 5.2.
Auswirkungen:
- höhere Zinkkonzentration (0.10-0.18 mg/L bei Maische-pH von 5.5-5.6) führt zu einer besseren Gärungsleistung und zu einem "weicheren" Bier
- höherer Polyphenolgehalt führt zu besserem Geschmack und Geschmacksstabilität
- höherer Würzesäuregrad beschleunigt den pH-Abfall während der Gärung und unterstützt die mikrobielle Stabilität
- Maischeansäuerung fördert die Phosphatpufferung und damit die pH-Stabilität
Bierreifung und Geschmacksempfindung)
Der optimale pH-Wert ist abhängig von der Biersorte und bewegt sich zwischen 3.2 (Berliner Weisse) bis 4.80
(Tschechisches Pilsner, Bock)
Bierstil und optimaler pH-Wert:
Tschechisches Pilsner, Bockbier pH 4.50 - 4.80
Kölsch, Altbier pH 4.15 - 4.40
Bayrisches Hefeweizen pH 4.10 - 4.40
Lambic pH 3.40 - 3.90
Geuze, Himbeer (Framboise)-Bier pH 3.30 - 4.50
Berliner Weisse pH 3.20 -3.40
Auswirkungen:
- fertige Biere mit pH < 4.40 weisen eine bessere Schaumqualität und eine hohe Schaumstabilität auf
- kohlensaures Bier wird häufig mit Attributen versehen wie: wohlschmeckend, frisch, süffig, ausgewogen,
angenehm bitter.
2.3.5. Die Bestimmung des pH-Wertes im Bierlabor
Der pH-Wert und die Temperatur gehören zu den herausragenden Prozessparametern, welche die Bierentstehung über den gesamten Produktiondprozess hinweg beeinflussen! Der pH-Wert in Hefe-Anzuchtlösungen, Maische, Bierwürzen, Gärlösungen und auch im Endprodukt Bier kann für Heimbrauzwecke auf 2 verschiedenen Arten bestimmt werden (Abb. 14). Wichtig: der Ph-Wert sollte unabhängig von der Methode immer bei Zimmertemperatur, d.h. optimal bei 20 °C bestimmt werden.
-
Indikatorfarbstoffe: einfach, aber relativ ungenau mittels visueller Bewertung der Farbumschläge
von Indikatorfarbstoffen. Die Auswertung erfolgt meist anhand von Farbvergleichsskalen
(vgl. Abb. 6). Indikatorpapiere, Indikatorteststäbchen, Indikatorteststreifen, (Info).
Info Indikatorpapiere Pehanon, Teststäbchen pH-Fix.
-
pH-Meter (Potentiometrie): auf elektrochemischem Weg auf dem Prinzip der Potentiometer kann
der pH-Wert wesentlich genauer als mit Farbindikatoren gemessen werden (Info). Für den Heim-
brauer gibt es verschiedene, auch preisgünstige pH-Meter (Info 1, Info 2).
Detaillierte Anleitungen zur pH-Bestimmung sind auf der Seite "Physikalisch-chemische Untersuchungen im
Braulabor" zu finden (siehe hier).
Hier geht es direkt zur PDF-Anleitung "Bestimmung pH-Wert mit Indikatoren und pH-Messgeräten".
Abb. 14. pH-Messungen können mit pH-Papieren/ pH-Teststäbchen bzw. pH-Teststreifen (= mit Indikatorfarbstoffen) oder präziser mit pH-Metern durchgeführt werden.
LaborPraxis (Juli/August 2010): Kalibrierung
2.4. Kenngrösse 3: Die GESAMTWASSERHÄRTE GH
2.4.1. Was versteht man unter der "Härte des Wassers"?
Die Gesamthärte eines Wassers wird ausschliesslich durch die Konzentrationssumme der als Karbonate CO3 2-, Sulfate SO4 2-, Chloride Cl-, Nitrate NO3- und Phosphate PO4 3- gebundenen Erdalkali-Ionen Calcium Ca2+, Magnesium Mg2+, Strontium Sr2+ und Barium Ba2+ bestimmt. In der trink- und brauwasseranalytischen Praxis aber spielen die Ba2+ und Sr2+ -Ionen keine Rolle, da sie nur in Spuren vorkommen und kaum zur Wasserhärte etwas beitragen. Wasser mit hohem Gehalt an Calcium- und Magnesiumsalzen wie z.B. CaCO3 (Kalk), Ca(OH)2, Ca(HCO3)2, CaSO4 (Gips), CaCl2, Ca(NO3)2, Ca3(PO4)2, CaHPO4 bzw. MgCO3, Mg(OH)2, Mg(HCO3)2, MgSO4, MgCl2, Mg(NO3)2, MgHPO4, Mg(H2PO4)2, Mg3(PO4)2 bezeichnet man als "hart", Wasser mit geringem Gehalt an diesen Salzen als "weich".
Magnesium- und Calciumionen Mg2+ und Ca2+ gelangen durch Lösungsvorgänge ins Wasser, z.B. durch Auflösung von Calciumsulfat (CaSO4.2H2O, Gips). Der Hauptanteil der Wasserhärte entsteht jedoch als Karbonathärte durch Auflösung von Calciumkarbonat CaCO3 (= Kalk) bzw. Dolomit, eines Ca-Mg-Mischkarbonats (CaMg(CO3)2, (CaCO3·MgCO3)) durch Kohlensäure H2CO3 (= gelöstes Kohlenstoffdioxid CO2: CO2 + H2O <--> H2CO3) unter Bildung löslicher Hydrogenkarbonate HCO3-. Das CO2 entstammt biologischen Prozessen im Boden, überwiegend aus der Atmung der Organismen, wo vor allem der mikrobielle Abbau organischer Substanzen erhöhte CO2-Konzentrationen liefert (Bsp. Veratmung von Kohlenhydraten, Summengleichung: C6H12O6 + 6 O2 --> 6 CO2 + 6 H2O. Damit kann die Auflösung des Kalks summarisch wie folgt dargestellt werden: CaCO3 (Kalk) + CO2 + H2O --> Ca2+ + 2 HCO3-.
Aber auch die in sauren Niederschlägen ("saurer Regen") enthaltenen Säuren können zu einem Härteanstieg führen. Beteiligt sind vor allem Schweflige Säure und Schwefelsäure (S-haltige Brennstoffe --> SO2 (Schwefeldioxid) + H2O --> H2SO3 (Schweflige Säure) [Info]; 2 SO2 + O2 + H2O --> 2 H2SO4 (Schwefelsäure [Info], H2SO4 + 2 H2O --> 2 H3O+ + 2 SO4 2-), aber auch Salpetersäure HNO3 (Verbrennungsvorgänge --> Stickstoffoxide: 2 NO (Stickstoffmonoxid) + O2 --> 2 NO2 (Stickstoffdioxid); 4 NO2 + 2 H2O + O2 --> 4 HNO3 (Salpetersäure), HNO3 + H2O --> H3O+ + NO3- (Nitrat).
Kalkauflösung: CaCO3 (Kalk) + 2 H3O+ ("Säureteilchen" aus HNO3 bzw. H2SO4 bzw. H2SO3) --> Ca2+ + 3 H2O + CO2 .
Auch aus dem mikrobiellen Abbau von Biomasse (z.B. toter Wurzeln, Blätter) und aus der landwirtschaftlichen Düngung wird Ammonium NH4+ freigesetzt, das über weitere Reaktionen in Salpetrige Säure HNO2 und schliesslich zu Salpetersäure HNO3, was ebenfalls kalklösend und damit härtesteigernd wirkt.
In der Braupraxis sind bezüglich der Wasserhärte praktisch nur die chemisch wirksamen Calcium- und Magnesiumsalze von Bedeutung.
Dazu muss man deren Konzentration im Rahmen der Wasserhärte kennen:
1 °fH = französischer Härtegrad = 10 mg CaCO3/L = 10 ppm
1 °dH = deutscher Härtegrad = 10 mg CaO/L = 17.85 mg/L CaCO3 = 7.15 mg Ca/L
bzw. 7.19 mg MgO = 17.85 ppm = 0,18 mmol/L Erdalkali-Ionen
1 amerikanischer Härtegrad = 1 ppm CaCO3 = 1 mg CaCO3/L
Umrechnung:
1 °fH = 0.56 °dH = 10.00 ppm
1 °dH = 1.79 °fH = 17.90 ppm
1 °am H.ppm = 0.056 °dH = 0.1 °fH
Es hat sich eingebürgert, dass man drei Härten unterscheidet:
-
Gesamthärte GH: Summe der Härtebildner Calcium und Magnesium, d.h. sie
umfasst alle Ca- und Mg-Verbindungen (Calciumhärte + Magnesiumhärte).
2. Karbonathärte KH (Carbonathärte, auch "vorübergehende Härte", "temporäre Härte"):
umfasst alle Ca- und Mg-Verbindungen mit Carbonaten CO3 2- und Hydrogen-
carbonaten HCO3- (CaCO3, Ca(HCO3)2, MgCO3, Mg(HCO3)2). KH ist meist niedriger
als die GH.
3. Nichtcarbonathärte NKH (auch "bleibende Härte", "permanente Härte"): umfasst die Ca-
und Mg-Verbindungen der Schwefelsäure (Sulfate: CaSO4, MgSO4), der Salzsäure
(Chloride: CaCl2, MgCl2), der Salpetersäure (Nitrate: Ca(NO3)2, Mg(NO3)2 ) und der
Phosphorsäure (Phosphate: Ca(H2PO4), Ca3(PO4)2, CaHPO4, Ca5(PO4)3·OH;
Mg(H2PO4)2, MgHPO4, Mg3(PO4)2 ); wird rechnerisch erfasst als Gesamthärte minus
Carbonathärte: NKH = GH - KH.
Weitere Ionen, insbesondere die Natrium-Ionen Na+ können auch noch mit den Hydrogen-
karbonat-Ionen HCO3- vorkommen, werden aber nicht zur Gesamthärte gezählt, sondern
zum Gesamtsalzgehalt. Diese braurelevanten Ionen sind in Abb. 15 kurz zusammenfassend
charakterisiert, in Abb. 16 erweitert dargestellt (sehr empfehlenswerterArtikel: Info).

Abb. 16. Gesamtsalzgehalt.
Der Gesamtsalzgehalt im Brauwasser setzt sich aus der Gesamthärte plus Natrium-Ionen Na+ zusammen.
Die Gesamtwasserhärte GH wiederum wird schwerpunkt-mässig von 1. der Konzentration der Kationen von Erdalkalimetallen, primär Calcium Ca2+ und Magnesium Mg2+, 2. der (temporären bzw. vorübergehenden) Karbonathärte KH mit primär den Anionen Hydrogenkarbonat HCO3-, und 3. der (permanten bzw. bleibenden) Nichtkarbonathärte NKH, primär den Anionen Chloride Cl-, Nitrate NO3- und Sulfate SO4 2- bestimmt.
[Quelle: Staudt, 2015, mod.]
Abb. 15. Braurelevante Ionen und deren wichtigsten Aus-wirkungen auf den Brauprozess (siehe auch hier).

2.4.2. Allgemeine und brautechnische Auswirkungen der Wasserhärte
Weiches Wasser ist günstiger für alle Anwendungen, bei denen das Wasser erhitzt wird, zum Waschen, zum Giessen von Zimmerpflanzen etc. Nachteilig sind jedoch die starke Schaumbildung bei Waschmitteln und die schlechte Entfernbarkeit von Seife z. B. beim Händewaschen.
Weiches Wasser steht in Granit, Gneis und Basalt-Gesteinen zur Verfügung (Bsp. Schweiz: Tessin). Auch Regenwasser ist von Natur aus meist sauber und daher weich.
Hartes Wasser führt zur Verkalkung von Haushaltsgeräten, erhöht den Verbrauch von Spül- und Waschmitteln, beeinträchtigt oder fördert, je nach dem Mass der Härte, den Geschmack und das Aussehen empfindlicher Speisen und Getränke (z. B. Tee). Hartes Wasser kommt aus Regionen, in denen Sand- und Kalkgesteine vorherrschen.
Brauwesen: Im Zusammenhang mit dem Brauprozess haben die Gesamthärte und vor allem die Restalkalität (cf. Pkt. 2.7) des Brauwassers erheblichen Einfluss auf technologische Qualitätskriterien, da die Wasserionen H+ (H3O+) den pH-Wert von Maische, Würze und Bier beeinflussen (cf. pH-Wert im Brauprozess).
Die Gesamthärte des Wassers kann im Gegensatz zur Karbonathärte positive Wirkungen beim Brauen entfalten, da die Härtebildner Calcium und Magnesium durch Reaktionen mit Maischebestandteilen Säure freisetzen und dadurch einen Teil der unerwünschten Karbonathärte "neutralisieren" (vgl. 3.4. Die Bestimmung der Karbonathärte hier).
Bsp.: Ca(HCO3)2 + 2 KH2PO4 <--> CaHPO4↓ + K2HPO4 + 2 H2O + 2 CO2↑
z.T. auch bei hoher Konzentration an Ca(HCO3)2: 3 Ca(HCO3)2 + 4 K2HPO4 <--> Ca3(PO4)2↓ + 2 K2HPO4 + 6 H2O + 6 CO2↑.
!! Die Bestimmung der Gesamthärte ist aber primär zur Berechnung der wichtigen Restalkalität (vgl. 2.8 Restalkalität) notwendig !!
2.4.3. Die Bestimmung der Gesamthärte
Die Bestimmung der Gesamthärte kann titrimetrisch erfolgen. Calcium- und Magnesium-Ionen (Ca2+, Mg2+) bilden mit einem Indikator eine rote Komplex-verbindung; aus dieser wird beim Titrieren mit einer Lösung von Ethylendinitrilotetraessigsäure Dinatriumsalz-Dihydrat (EDTA: Komplexon, Titriplex III) der Indikator freigesetzt. Am Endpunkt der Titration erfolgt ein Farbumschlag nach Grün. Die Gesamthärte ergibt sich aus dem Verbrauch an Titrierlösung. (Merck: "Merck MColortest Gesamthärte-Test 1.08039.0001", Messbereich 10 - 360 mg/L CaCO3 bzw. 0.2-20 °dH = 1-36 °fH, Abstufung 0.2 °dH = 0.36 °fH (Info 1, Info 2), "Merck MColortest Gesamthärte-Test 1.08047.0001", Messbereich 1 - 100 mg/L CaCO3 bzw. 0.1-5.6 °dH = 0.18-10 °fH (Info 1, Info 2).
Eine einfachere Variante ist der halbquatitative Teststäbchennachweis, basierend auf dem gleichen Nachweisprinzip: Die mit unterschiedlichen Mengen Titriplex® III imprägnierten Reaktionszonen des Teststäbchens nehmen deshalb in Abhängigkeit von der Wasserhärte eine grüne bis rote Farbe an. Die Härte wird halbquantitativ durch visuellen Vergleich der Reaktionszonen mit den Farbreihen einer Farbskala* ermittelt
"Merck MQuant Gesamthärte-Test 1.17934.0001", Messbereich/Abstufung <150, 150-250, >250 mg/L CaCO3 bzw. <8,4 . 8,4 . 14 . >14 °dH = <15 . 15-25, >25 °fH (Info 1, Info 2, *Farbskala).
Die Firma MN (Macherey-Nagel) bietet vergleichbare Testsätze an (Info 1, Info 2).
Titrations-Testbestecke (Reaktionsprinzip: Komplexometrische Titration): "MN VISOCOLOR® alpha* Gesamthärte 935 042" (Messbereich 1 Tropfen = 1 °dH (= 18 mg/L CaCO3) (Info 1, Info 2). "MN VISOCOLOR® ECO** Gesamthärte 931 029" (Messbereich 1 Tropfen = 1 °dH (= 18 mg/L CaCO3) (Info 1, Info 2, Testanleitung). "MN VISOCOLOR® HE*** Gesamthärte HE H 20 F 915 005" (Messbereich 0,5 – 20,0 °dH, Abstufung 1 Teilstrich = 0,5 °dH) (Info 1, Info 2, Testanleitung).
Teststäbchen: Teststäbchen "MN Aquadur Sensitive 91243" (Messbereich 5-20 ppm CaCO3 (0,3-1,1 °dH),
Farbabstufungen 0 . 5 . 10 . 20 ppm CaCO3 bzw. 0 . 0,3 . 0,6 . 1,1 °dH bzw. 0 . 0,5 . 1,1 . 2 °fH,
Info 1, Info 2); Teststäbchen z.B. "MN Aquadur 91201" (Messbereich 53,6-446 mg/L CaCO3 (< 3- >25 °dH),
Farbabstufungen <3 ° . >5 . >10 . >15 . <20 . > 25 °dH, bzw. <5.3 . >8,9 . >17,8 . >26,7 . < 35,6 .
>44,5 °fH (Info 1, Info 2). Wasserhärte-Teststäbchen "MN DiaQuant® Wasserhärte 932009" (Messbereich
0-20 mg/L CaCO3, Abstufung: 0 · 5 · 10 · 20 mg/L CaCO3 bzw. 0 . 0,3 . 0,6 . 1.1 °dH = 0 . 0,54 . 1,1 .
2 °df (Info 1, Info 2). Weitere Messbereiche und Abstufungen: siehe hier.
Hinweise zu MN-Tests: * alpha: einfach und kompakt, preisgünstig (Info). ** ECO: höhere Genauigkeit und Empfindlichkeit.
*** HE: höchstempfindlich und präzise. (Info über alpha, ECO und HE: hier).
Detaillierte Anleitungen zur Bestimmung der Gesamtwasserhärte sind auf der Seite "Physikalisch-chemische Untersuchungen im
Braulabor" zu finden (siehe hier).
Hier geht es direkt zur PDF-Anleitung "Bestimmung der Gesamtwasserhärte. Messgeräte und Vorgehen".
Abb.17. Die Bestimmung der Gesamthärte ist titrimetrisch oder kolorimetrisch möglich.
2.5. Kenngrösse 4: Die KARBONATHÄRTE KH
2.5.1. Was versteht man unter der "Karbonathärte des Wassers"?
Die Karbonathärte KH (auch Carbonathärte, vorübergehende Härte, temporäre Härte, nichtpermante Härte, Alkalität, Alkalinität, Gesamtalkalinität, Basizität, engl. Total Alkalinity TA) ist bedingt durch die Bicarbonate des Calciums und Magnesiums. Sie umfasst alle Ca- und Mg-Verbindungen mit Carbonaten CO3 2- und Hydrogencarbonaten HCO3- (CaCO3, Ca(HCO3)2, MgCO3, Mg(HCO3)2).
Sie wurde deshalb früher auch als vorübergehende bzw. temporäre Härte bezeichnet, da beim Kochen des Wassers die löslichen Erdalkalihydrogenkarbonate unter Abspaltung von CO2 in mehr oder weniger lösliche Karbonate umgewandelt werden.
Summarisch wird es häufig wie folgt dargestellt: Ca2+ + Mg2+ + 4 HCO3- --> CaCO3↓ + MgCO3↓ + 2 H2O + 2 CO2.
Eine genauere Betrachtung ergibt:
Ca-Ausfällung: Calcium Ca(HCO3)2 <--> Ca2+ + 2 HCO3- <--> CaCO3*↓ (Ausfällung: Kesselstein) + CO2↑ (Entweichung) + H2O *: nur ein kleiner Restanteil = ca. 0.8 °dH = 1.4 °fH = 14 ppm = 14 mg CaCO3/1 L H2O bleiben gelöst
Mg-Ausfällung: Mg(HCO3)2) --> MgCO3 (aber viel löslicher als CaCO3) + CO2↑ (Entweichung) + H2O --> diese Reaktion spielt sich infolge der viel besseren Löslichkeit von MgCO3 (110 ppm = 110 mg/L) aber kaum eine Rolle !! Das entstehende Magnesiumkarbonat kann somit auch durch längeres Kochen kaum ausgeschieden werden.
NaHCO3 Natriumhydrogenkarbonat und Natriumkarbonat (Soda) Na2CO3/ Na2CO3.10H2O können durch Kochen in ihrer Konzentration nicht verringert werden.
Fazit: Beim Erhitzen wird das Wasser primär durch die Calciumausfällung als Kalkstein "weicher".
Die Karbonathärte KH ist meist etwas niedriger als die Gesamthärte GH: KH < GH.
2.5.2. Die Bedeutung der Karbonathärte für den Brauprozess
Kalkstein/Kesselstein: Die löslichen Karbonate sind sehr instabil und gehen dadurch beim Erhitzen bereits oberhalb von etwa 60 °C in unlösliche Calcium-Karbonatverbindungen über --> Bildung von Kalkstein, Ablagerung als Kesselstein. Dies ist bei Geräten natürlich ungünstig (Bsp. Pfannen, Boiler, Sudkessel).
Abbau von Säure ("aciditätsvernichtend", "Säurevernichter", "Säurebindend"), pH-Wert erhöhend: Bei der Einschätzung der Eignung des Brauwassers für den gewünschten Biertyp (z.B. Pilsner: Gesamthärte 2.3 °dH, 4.1 °fH , 41.2 ppm, Karbonathärte 1.4 °dH, 2.5 °fH , 25 ppm; Wiener: Gesamthärte 38.6 °dH, 69.1 °fH , 691 ppm, Karbonathärte 30.9 °dH, 55.3 °fH , 553 ppm) ist die Karbonathärte von zentraler Bedeutung, denn sie ist durch die Hydrogenkarbonat-Ionen HCO3- "säurevernichtend bzw. aciditätsvernichtend", oder, anders formuliert, die Alkalinität steigt: HCO3- + H+ (Proton, "Säureteilchen", cf. hier) --> H2O + CO2↑. Genauere Reaktionsformulierung: HCO3- + H3O+ (Oxonium-Ion, syn. Hydronium-Ion, "Säureteilchen", cf. hier) --> 2 H2O + CO2↑.
Je grösser die Menge an gelöstem Hydrogenkarbonat - je höher die Karbonathärte - im Wasser, desto mehr Wasserstoffionen (Protonen H+ bzw. eben Oxonium-Ionen H3O+) werden "abgefangen" und desto grösser ist dieser pH-Wert erhöhende Effekt. !! Gegenteiliger Effekt der Ca2+- und Mg2+-Ionen: cf. Restalkalität!!
Die Hydrogenkarbonat-Ionen entziehen beim Erhitzen oder allgemein bei chemischen Reaktionen die H+-Ionen und damit steigt der pH-Wert in Richtung alkalisch/basisch, oder anders formuliert: die Alkalität steigt. Dies hat weitreichende Auswirkungen auf den gesamten Brauprozess, z.B. stärkere Auslaugung von Malzgerbstoffen --> derber Biergeschmack, Intensivierung der Bierfarbe; Beeinträchtigung der Maischeenzymaktivitäten (Wirkungsoptimum der beta-Amylasen bei pH 5.4 wird nicht erreicht --> schlechter Vergärungsgrad); Würzekochen resultiert in verstärkter Lösung von Hopfenbitterstoffen --> kratzige, unangenehme und nachhängende Bittere im trinkfertigen Bier, besonders bei hellen, stärker gehopften Bieren.
2.5.3. Die Bestimmung der Karbonathärte
Die Bestimmung der Karbonathärte, also der im Wasser enthaltenen Karbonat- und Hydrogenkarbonat-Ionen (CO3 2-, HCO3-) sowie den bei deren Hydrolyse entstandenen Hydroxyl-Ionen OH-, der durch den Anteil der Erdalkali-Ionen hervorgerufen wird und der Summe der CO3 2- + HCO3- + OH- -Ionen äquivalent ist, kann titrimetrisch (= acidimetrisch) bestimmt werden. Hinweis: Enthält ein Wasser mehr Äquivalente an Karbonat- und Hydrogenkarbonat-Ionen als an Erdalkali-Ionen, so ergibt sich ein höherer Wert für die Kartbonathärte als für die Gesamthärte! In diesem Fall wird als Karbonathärte die Gesamthärte angegeben: GH ≡ KH.
Prinzip Karbonhärte-Schnelltest: Die mit dem Farbindikator Phenolphthalein bzw. Mischindikator versetzte Untersuchungslösung wird mit eingestellter Salzsäure oder Schwefelsäure bis zum Farbumschlag auf Farblos oder Violett titriert (Messbereich: Merck MColortest 108048 0.2-20 °dH, Abstufung: 0.2 °dH (Info 1, Info 2: S. 2); MColortest 111103 1 Tropfen Reagens = 1 °dH (Info 1, Info 2: S. 3); MColortest 114653 1 Tropfen Reagens = 1 °dH (Info 1, Info 2: S. 4).
Der Test kann auch einfacher, aber nur halbquantitativ mit Carbonathärte-Teststäbchen durchgeführt werden (Merck MQuant: Messbereich/ Abstufung: 4-8-12-16-24 °dH (Info 1, Info 2).
Die Firma MN (Macherey-Nagel) bietet vergleichbare Testsätze an. 1. Tititrimetrische Bestimmung
der Karbonathärte mit Salzsäure: "VISOCOLOR® HE Carbonathärte C 20", 0.5-20 °dH, Abstufung
0.5 °dH (Info 1, Info 2); "VISOCOLOR® ECO Carbonathärte 931 014", 1 Tropfen = 1 °dH (Info 1,
Info 2, Testanleitung). 2. Kolorimetrischer Farbvergleich mit Farbkarte (Info): "VISOCOLOR® alpha
Carbonathärte 935 016", 1 Tropfen = 1 °dH (= 18 mg/L CaCO3) (Info 1, Info 2).
Detailliertere Anleitungen zur Bestimmung der Karbonathärte sind auf der Seite "Physikalisch-chemische
Untersuchungen im physikalisch-chemischen Braulabor" zu finden (siehe hier).
Hier geht es direkt zu einer einfachen Titrationsmethode aus einfachen Materialien konzipiert:
siehe PDF-Anleitung "Bestimmung der Karbonathärte KH".
Abb. 18. Bestimmung der Karbonathärte mit käuflichen Fertigtests oder selbst zusammen-gestelltem Test.
2.6. Kenngrössen 5: CALCIUM Ca2+ und MAGNESIUM Mg2+
2.6.1. Erdalkali-Ionen: Ca2+ und Mg2+-Kationen
Calcium. Die Rolle des Calciums bzw. der Calciumionen Ca2+ ist bereits schon bei der Gesamthärte (Kap. 2.4, cf. hier),
der Karbonathärte (Kap. 2.5, cf. hier), der Nichtkarbonathärte (Kap. 2.7, cf. hier) und der Restalkalität (Kap. 2.8, cf. hier)
besprochen. Calcium spielt offenbar eine dominierende Rolle bei fast jedem Aspekt im Brauprozess.
Hier soll nur noch in aller Kürze die wesentlichsten Punkte zusammen gefasst werden. Calcium ist beteiligt an
- Maischprozess: zusätzliche Freisetzung von Säuren --> aciditätsfördernd --> pH-Wert erniedrigt sich:
3 Ca2+ + 2 HPO4 2- (aus Malz) ---> Ca3(PO4)2 + 2 H+
- Schlüsselgrösse Restalkalität: Ca2+ -Ionen erniedrigen die Restalkalität
- Nichtkarbonathärte NKH: Calcium ist hauptverantwortlich für die NKH, also für die permanente Härte
- Proteinausfällung: Calcium begünstigt die Ausfällung der Eiweisse bei der Bruchbildung während des Kochens
- Calciumkonzentration: zu viel Calcium resultiert in kratzender Hopfenbittere
- Konzentrationsrichtwert: im Brauwasser ca. 100 mg/L.
Magnesium. Magnesium spielt eine ähnliche, wenngleich auch deutlich schwächere Rolle als Calcium. Es ist ebenfalls in den für Calcium erwähnten Kapiteln angesprochen.
- Maischprozess: ebenfalls säurefördernd, aber deutlich schwächer als Calcium (3 Mg2+ + 2 HPO4 2- (aus Malz) ---> Mg3(PO4)2 + 2 H+
- Restalkalität: wird ebenfalls durch Mg2+ erniedrigt, aber nur mit der Hälfte der Ca-Wirkungskraft
- Nichtkarbonathärte NKH: neben Calcium mitverantwortlich für die NKH
- Magnesium ist ein wichtiges mineralisches Nährelement für die Hefen
- Magnesiumkonzentration: wenn zu hoch, entfaltet es eine adstringierende Wirkung --> unangenehme Bittere, Verstärkung der Hopfenbittere, trockener
Geschmackseindruck
- Konzentrationsrichtwert: 10 - 30 mg/L
2.6.2. Die Bedeutung der Ca2+/Mg2+ -Ionen für den Brauprozess
Kernwissen für Braupraxis: Calcium Ca2+ und Magnesium Mg2+ -Ionen sorgen im Maischeprozess für zusätzliche Säurefreisetzung (chemische Reaktionsgleichung oben –> Erniedrigung der Restalkalität, Erniedrigung Maische-pH-Wert).
2.6.3 Die Bestimmung der Calcium- und Magnesiumhärte
Die Bestimmung der Calciumhärte erfolgt mittels einer komplexometrischen Titration in stark
alkalischer Lösung nach Ausfällung der Magnesiumsalze (Bsp. MN Visocolor ECO Calcium-Test, Info,
Merck MColortest Calcium, Info).
Bei zusätzlicher Bestimmung der Gesamthärte kann rechnerisch der Magnesium-Gehalt ermittelt
werden.
Detailliertere Anleitungen zur Bestimmung der Karbonathärte sind auf der Seite "Physikalisch-chemische
Untersuchungen im physikalisch-chemischen Braulabor" zu finden unter "3.6. Die Bestimmung der
Calcium- und Magnesiumionen" (siehe hier).
Hier geht es direkt zur PDF-Anleitung "Bestimmung der Calcium- und Magnesiumhärte".
[Quelle]
Abb. 19. Bestimmung der Calciumhärte mit dem MN Visocolor ECO-Testbesteck oder eXact-iDip-Fotometer.
2.7. Kenngrösse 6: Die NICHTKARBONATHÄRTE NKH
2.7.1. Was versteht man unter der "Nichtkarbonathärte des Wassers"?
Die Nichtkarbonathärte NKH wird auch als "Mineralsäurehärte" , "Resthärte", "bleibende
Härte" oder "permanente Härte" bezeichnet, da sie sich im Gegensatz zur Karbonathärte
unter den Bedingungen des Kochens nicht verändert. Sie umfasst denjenigen Teil der
Calcium- und Magnesium-Kationen-Verbindungen, die nicht an die Anionen des Hydro-
genkarbonat HCO3- gebunden sind (= Karbonathärte), sondern an andere Anionen wie
der Schwefelsäure (Sulfate SO4 2-: CaSO4, MgSO4) und der Salzsäure (Chloride Cl-: CaCl2,
MgCl2), aber auch der Salpetersäure (Nitrate NO3-: Ca(NO3)2, Mg(NO3)2 ), der Phosphor-
säure (Phosphate PO4 3-: Ca(H2PO4), Ca3(PO4)2, CaHPO4, Ca5(PO4)3·OH; Mg(H2PO4)2,
MgHPO4, Mg3(PO4)2 ) und Silicate (z.B. CaSIO3, MgO·xSiO2); cf. auch Abb. 20.
2.7.2. Die Bedeutung der Nichtkarbonathärte für den Brauprozess
Die Nichtkarbonathärte hat an der Gesamthärte GH meist den kleineren Anteil und ist
auch für das Brauen von untergeordneter Bedeutung, da die mineralsauren Salze den
Maischprozess kaum beeinträchtigen. Die NK-Härte spielt nur dann eine Rolle, wenn
ein Wasser mit hoher Nichtkarbonathärte zum Brauen eines typisch weichen und sehr
schlanken Pilsners verwendet wird und praktisch entmineralisiert werden muss. Für alle
anderen Bierstile sind einfachere Methoden ausreichend (siehe Kap. Aufbereitung des
Wassers), zumal insbesondere bei dunkleren Malzen unter Umständen ein zu niedriger pH-Wert und geschmackliche Einbussen die Folge sein können.
2.7.3. Die Bestimmung der Nichtkarbonathärte
Die Nichtkarbonathärte ist eine reine Rechengrösse und wird aus der Differenz aus der Gesamthärte GH
und der Karbonathärte KH bestimmt.
-
Bestimmung der Gesamthärte: cf. Kap. 2.4. (Theorie und knapper Methodenbeschrieb hier) sowie
Seite "Physikalisch-chemisches Braulabor" hier, Methode hier.
2. Bestimmung der Karbonathärte: cf. Kap. 2.5. (Theorie und knapper Methodenbeschrieb hier) sowie
Seite "Physikalisch-chemisches Braulabor" hier, Methode hier.
3. Berechnung der NKH:
Nichtkarbonathärte NKH [°dH] = Gesamthärte GH [°dH] - Karbonathärte KH [°dH]
Detaillierte Anleitungen zur Bestimmung der Nichtkarbonathärte sind auf der Seite "Physikalisch-chemische
Untersuchungen im Braulabor" zu finden (siehe hier).
Hier geht es direkt zur PDF-Anleitung "Bestimmung der Nichtkarbonathärte".

Abb. 20. Wasserhärte und der Anteil der Nichtkarbonathärte NKH. [Quelle]
NKH umfasst die Konzentration all jener Erdalkalikationen für die im ungelösten Zustand kein Hydrogencarbonatanion mehr übrig bliebe. Es handelt sich dabei vor allem um Chlorid- und Sulfatverbindungen.
Abb. 21. Nichtkarbonathärte NKH.
Bestimmung bzw. Berechnung der Nichtkarbo-nathärte NKH aus Gesamthärte GH und Karbonathärte KH.
2.8. Kenngrösse 7: Die RESTALKALITÄT - eine entscheidende Kenngrösse für eine optimale Maische
2.8.1. Was versteht man unter der "Restalkalität"? Siehe auch hier. Info.
Karbonathärte. Die im Kap. 2.6. angesprochene Karbonathärte KH ist bedingt durch die Verbindungen der Hydrogenkarbonat-Anionen HCO3- mit Calcium- und Magnesium-Kationen. Wie schon in 2.4.1. dargestellt, entstehen die gelösten Hydrogenkarbonate, wenn Wasser, in dem CO2 gelöst ist, durch kalkhaltiges Gestein fliesst; dabei wird unlösliches Calciumkarbonat in lösliches Calciumhydrogenkarbonat umgewandelt: CaCO3 + CO2 + H2O --> Ca(HCO3)2 --> Ca2+ + 2 HCO3-. Diese Karbonathärte ist von zentraler Bedeutung, denn sie ist durch die Hydrogenkarbonat-Ionen HCO3- "säurevernichtend bzw. aciditäts-vernichtend", oder, anders formuliert, die Alkalinität steigt:
Reaktionsgleichung 1: HCO3- + H3O+ (Oxonium-Ion, syn. Hydronium-Ion, "Säureteilchen", cf. hier) --> 2 H2O + CO2↑ --> die HCO3- -Ionen sind also den pH-Wert erhöhende Ionen. Je grösser die Menge an gelöstem Hydrogenkarbonat - je höher also die Karbonathärte - im Wasser, desto mehr Wasserstoffionen (= Protonen H+ bzw. eben Oxonium-Ionen H3O+) werden "abgefangen" und desto grösser wird dieser pH-Wert.
Ca2+-/Mg2+-Ionen: aciditätsfördernd. Ein gegenteiliger Effekt wird nun durch die Ca2+- und Mg2+-Kationen bewirkt: in der Maische reagieren sie mit den Phosphat-Anionen PO4 3-, die aus dem Malz selbst stammen und setzen dabei Säureteilchen H+ bzw. H3O+ frei gemäss der
Reaktionsgleichung 2: 3 Ca2+ + 2 HPO4 2- ---> Ca3(PO4)2 + 2 H+/H3O+ --> die Ca2+ und die Mg2+ -Ionen sind also pH-Wert-erniedrigende Ionen.
Die frei gewordenen H+/H3O+-Ionen reagieren gemäss Reaktionsgleichung 1 mit Hydrogenkarbonat zu Wasser und Kohlenstoffdioxid CO2 und reduzieren somit die Menge der die Alkalinität bzw. den pH-Wert erhöhenden Stoffe! P. Kolbach (cf. Troester) konnte nachweisen, dass ca. 1.75 Ca2+-Ionen oder 3.5 Mg2+-Ionen ein Wasserstoff-Ion H+ freisetzen, das dann seinerseits von 1 HCO3- -Ion in 1 CO2 und 1 H2O umgewandelt wird und dadurch "säurevernichtende" HCO3- - Wirkung aufhebt.
Das Konzept der Restalkalität beschreibt nun die Wechselwirkung zwischen der Wasser-Gesamthärte GH, der Karbonathärte KH bzw. Alkalinität sowie der pH-abhängigen Karbonatlöslichkeit als H2CO3 (= "reine Kohlensäure", pH 1-6), Hydrogenkarbonat HCO3- (pH-Bereich 6-10) und Karbonat CO3 2- (pH-Bereich 10-13) (Info > Abb. 2). Diese Pufferwirkung (Puffer: abfedernde Wirkung einer Säurezugabe bzw. Säurefreisetzung) [Info]) zwischen der säurevernichtenden HCO3--Wirkung und der säurefördernden Ca2+ und Mg2+ -Wirkung wird mit den Daten aus 1. der Wasser-Gesamthärte GH, 2. der Karbonathärte KH und 3. der Calciumhärte berechnet. Ganz vereinfacht lässt sich anschaulich sagen, dass die Restalkalität die Fähigkeit des Brauwassers ist, Säuren zu neutralisieren. Anders formuliert: Restalkalität RA ist nicht kompensierte Alkalität und treibt den pH-Wert ungünstigerweise nach oben.
Die wichtige Aussagekraft der Restalkalität für den Brauer ist: "Was bleibt je nach Ca/Mg-Konzentration und der Karbonatkonzentration von der säurevernichtenden Wirkung der Karbonathärte übrig?"
2.8.2. Die Bedeutung der Restalkalität für den Brauprozess
Eine zu hohe Restalkalität RA ist für viele Brauphänomene entscheidend, insbesondere da sie Auskunft über den zu erwartenden pH-Wert in Maische und Würze gibt. Sie kann Folgendes bewirken bzw. beeinflussen:
-
zu hoher Maische-pH-Wert --> für die pH-abhängigen stärkespaltenden Enzymaktivitäten
zw. pH 5.4 (β-Amylase) und 5.6 (α-Amylase) nicht optimal, unvollständige Verzuckerung,
schlechtere Sudhausausbeute
-
schlechte Eiweissausscheidung (Eiweissbruch, Proteinkoagulation) während Würzekochen
--> im Heiss- und Kalttrub; optimaler pH-Wert für die Proteinausfällung wäre < 5.2)
-
Hemmung der Enzyme des Glucanabbaus --> höhere Viskosität der Maische --> Läuterprobleme
(Läutern weniger effizient)
-
verstärkt unerwünschte Auslaugung von Gerbstoffen aus Spelzen
-
höhere Hopfenausnutzung --> kann harsche Hopfenbittere verursachen
-
pH > 6: höhere Tanninlöslichkeit --> bessere (unerwünschte) Tanninauslaugung
-
Zufärbung (höhere Farbintensivierung beim Würzekochen) --> dunklere Biere
-
schlechtere Hefevermehrung (geringere Wachstumsraten)
-
Quantifizierung: jeweils 10 °dH RA verschieben den pH-Wert der Braumalze in der Maische um
ca. plus/minus 0.3 pH-Einheiten. RA = 0 °dH entspricht völlig salzfreiem Wasser (entionisiertes
Wasser)
Richtlinien zur Restalkalität.
Kolbach, P. (Info): RA = 5 °dH --> keine Enthärtung für hellere Biere notwendig
Narziss, L., Back, W. (Info, S. 55): Pilsener Biere RA ≤ 2 °dH, z.T. sogar negative RA empfehlenswert
Brücklmeier, J, (Info, S. 255): als Grenzwert oft 2 °dH angeführt, aber: dunkles Bier, Bier mit hohem
Farbmalz und Caramalzanteil, Biere mit hohem Weizenmalzanteil RA bis ≤ 10; helle Biere RA ≤ 5 °dH;
sehr helle und vor allem hopfenintensive Biere RA ≤ 2 °dH - 0 °dH
Göpper, S. (Info, S. 5): dunkle Biere, Hefeweizen RA ≤ 10 °dH, helle Biere ≤ 5 °dH, hopfenbetonte
Biere ≤ 0 °dH
Franke, M., Birmelin, M. (Info, S. 536): helle Biere um O °dH; für Export, Kölsch, Lager ≤ 5 °dH; Pilsbiere
z.T. bis -5 °dH; Weizenbier ≥ 5 °dH bis ≤ 10 °dH
besser bier brauen (Info): cf. Abb. 22 und 23
Staudt, A. (Info): Braumagazin Frühjahr 2015 > "Tabelle einiger beliebter Bierstile" (pdf).
Neben diesen RA-Empfehlungen gibt es den Evergreen "Chlorid-Sulfat-Verhältnis" zu beachten (Info). Zahlreiche empirische Empfehlungen verweisen auf ein bestimmtes Sulfat : Chlorid-Verhältnis:
- sulfatlastig ≤ 4:1 --> betonter Hopfencharakter
- chloridlastig ≤ 2:1 --> milder, malzbetonter Charakter
- Verhältnis Sulfat zu Chlorid 1:1 --> ausgewogener Charakter.
Allerdings sind solche SO4 2- : Cl- -Empfehlungen fragwürdig, denn sie beziehen sich auf das Roh-Brauwasser ohne das Malz - der Stammwürze-bedingte Eintrag von Chlorid und Sulfat ist nicht berücksichtigt. Von daher empfiehlt A. Staudt "Mit Chlorid und Sulfat unterhalb der etablierten Werte bleiben und bei hohen Stammwürzen mit Chlorid zurückhaltend sein. Das Verhältnis ignorieren" (Info, Ende Abschnitt 2.4 "Evergreen Chlorid-Sulfat-Verhältnis").
2.8.3. Die Berechnung der Restalkalität: experimentell oder nur rechnerisch aus amtlichen Gemeinde-Wasseranalysendaten
Die Braumalze reagieren in salzfreiem (entionisiertem) Wasser sauer und verschieben den pH-Wert auf ca. 5.2 bis 5.8. Das Brauwasser ab Leitungshahn ist jedoch nie ionenfrei, sondern hat immer mineralische und andere Stoffe gelöst. Je nach Zusammensetzung dieser Wasserinhaltsstoffe, insbesondere der Mineralien kann das Wasser die saure Reaktion des Malzes verringern: Dieses Phänomen der Restalkalität RA , also Wasserstoffionen (H+ bzw. ans Wasser H2O gebunden H3O+) zu binden wird mit der Einheit [°dH] quantifiziert. Ist die RA positiv, was fast immer der Fall ist, dann erhöht sich der pH-Wert. Ist die saure Reaktion von Calcium und Magnesium stärker als die alkalische Reaktion des Hydrogenkarbonats, wird die
Restalkalität demnach geringer und sogar negativ - ist die RA negativ, kann sie den pH-Wert senken. Dieser Effekt
wird bei der Zugabe von Brausalzen wie Gips (Calciumsulfat CaSO4 bzw. Ca[SO4]·2H2O) genutzt.
Es gibt nun einige rechnerische Ansätze, um über die Wasserzusammensetzung und die verwendeten Malze eine
Prognose über den Maische-pH-Wert zu machen und Berechnungen über die Zugabe von Brausalzen und Säuren
anzustellen, um dann zum Ziel-pH-Wert zu gelangen. Allerdings sind die Braumalze im Gegensatz zum Brauwasser
viel weniger homogen, die Rohdaten über den Säurebeitrag der Malze in Abhängigkeit von der Wasserzusammen-
setzung variabel (vgl. Kapitel "Aufbereitung bzw. Design des Brauwassers").
Im Folgenden geht es nur um die Berechnung der Restalkalität RA im Rohbrauwasser ab Leitungshahn ohne irgen-
dwelche Brausalzzusätze und natürlich noch noch ohne Malzzugaben.
Die Restalkalität RA wird mit den Kolbachschen Ca2+/Mg2+-aciditätsfördernden Faktoren berechnet werden,
sofern die Wassergesamthärte GH, die Karbonathärte KH und die Calciumhärte bekannt sind, entweder durch
Eigenmessungen oder durch die Wasserversorger.
Formeln für Restalkalität RA: --> Umrechner verschiedener Härteskalen hier!
-
Restalkalität RA [°dH] = Karbonathärte KH [°dH] - (Calciumhärte [°dH]/3.5) - (Magnesiumhärte [°dH]/7)
-
Restalkalität RA [°dH] = Karbonathärte KH [°dH] - (Calciumkonzentration [mg/L]/25.025) - (Magnesiumkonz. [mg/L]/30.38)
-
Restalkalität RA [°dH] = (Säurekapazität [mmol/L] x 2.8) - (Calciumkonzentration [mg/L]/25.025) - (Magnesiumkonz. [mg/L]/30.38)
-
Restalkalität RA [ppm CaCO3] = 0.83 x HCO3- -Konzentration [ppm] - (0.71 x Calciumkonzentration [ppm]) - (0.59 x Magnesiumkonz. [ppm])
Einfache Abschätzung der Restalkalität:
Überschlägig kann man die RA, z.B. bei Unkenntnis der Calcium- bzw. Magnesiumkonzentration, mit folgender Faustformel berechnen:
-
Restalkalität RA [°dH] = Karbonathärte KH [°dH] - (Gesamthärte GH [°dH]/3.5 oder 4).
Detaillierte Anleitungen zur Bestimmung der Restalkalität sind auf der Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).
Hier geht es direkt zur PDF-Anleitung "Bestimmung der Restalkalität".
Abb. 22. Bierstil und Restalkalität.
Lesebeispiel: Pilsner Bier braucht geringe Restalkalität, damit Ionenarmes (= salzarmes, möglichst "weiches") Brauwasser. [Quelle: besser bier brauen]

Abb. 23. Brauwasser bekannter Braustile.
Chemische Zusammensetzung typischer Brauwasser
[Quelle: besser bier brauen]
Abb. 24. Restalkalität.
Grundlage zur Brauwasserchemie (opti- maler Maische-pH-Wert) und Bierstil.
2.9. Kenngrössen 8: Weitere WASSERINHALTSSTOFFE
Was für weitere Wasserinhaltstoffe sind für das Brauwasser noch von Bedeutung?
NATRIUM. Natrium Na+ ist ein allgegenwärtiges Kation im Wasser. Es kann als Hydrogenkarbonat NaHCO3, Natriumkarbonat Na2CO3 (syn. Soda), Natriumchlorid NaCl ("Salz") und Natriumsulfat Na2SO4 neben anderen Na-Verbindungen im Wasser vorkommen und wird bei der Gesamthärte-bestimmung nicht erfasst. NaHCO3 und Na2CO3 sind ungünstig für den pH der Maische und Würze, da die entstehenden alkalischen Phosphate löslich sind. Im Zellmetabolismus der Hefen spielt Natrium physiologisch eine wichtige Rolle beim Kalium-Transport.
Auswirkungen Brauprozess:
- Natrium ist in geringen Konzentrationen (75-150 mg/L) für die Vollmundigkeit und das Mundgefühl wichtig
- Natrium wird durch Gerstenmalz in die Maische eingebracht (ca. 400 mg/L bei einem Stammwürzegehalt von 10 Grad Plato)
- zusammen mit Chloriden Cl- führt Natrium in Mengen > 150 mg/L und auch mit Kalium aus dem Malz zu salzigem, breiten Geschmack
- in Kombination mit hohen Hydrogenkarbonatkonzentrationen führt Natrium zu derber Bittere
Na-Werte im Bier [ppm = mg/L]: grosse Schwankungen (Pilsener Pilsen 3, Export Lager Dortmund 60, Wiener Lager 8, Oktoberfest München 2, British Bitter London 86, Scottish Ale Edinburgh 20, India Pale Ale Burton 44, Dry Stout Dublin 12).
Empfohlener Bereich zum Brauen (Richtwert): 0-50 ppm bzw. 10-70 mg/L, Maximalwert 100 mg/L (je nach Autor
verschieden, aber "weniger ist besser" [J. Palmer, C. Kaminski, Water, A comprehensive Guide for Brewers, 2013].
Nachweis: Es existiert keine einfache Nachweisanalytik; die üblicherweise eingesetzte Emissionsspektrografie
("Flammenfotometrie"), die Atomabsorptionsspektrografie und die Ionenchromatografie sprengen bei weitem
die Möglichkeiten eines Braulabors. In der Schweiz kann i.d.R. das kantonale Labor, das Trinkwasseranalysen
durchführt, eine solche Analyse durchführen (Bsp. Kanton. St. Gallen: cf. hier)
CHLORID. Chlorid-Anionen Cl- sind, im Gegensatz zu elementarem Chlor im Wasser natürlich vorkommende
Salzbestandteile, z.B. als Natriumchlorid Na+Cl-oder Calciumchlorid CaCl2.
Auswirkungen Brauprozess:
- als Calciumchlorid CaCl2 und Magnesiumchlorid MgCl2 beeinflussen sie den pH-Wert von Maische, Würze und Bier
- Chlorid-Ionen fördern in der Maische die Wirkung der stärkespaltenden α-Amylase
- Cl- -Ionen unterstützen die Malzsüsse positiv und sorgen für Vollmundigkeit und Mundgefühl
- als Calciumchlorid CaCl2 erzeugen sie einen vollen, weichen Biergeschmack
- über 100 mg/L: Gefahr einer Korrosion von Stahl, auch von Chrom-Nickelstahl, > 400 mg/L: salziger, derber Geschmack
Cl-Werte im Bier [ppm = mg/L]: München dunkles Bier 2, Pilsener Pilsen 5, Burton IPA, Ale 35, Wiener Lager 39, Köln Kölsch 72, Dublin Stout, Porter 75, Düsseldorf Alt 88, Dortmund Export 107
Richtwert: 0-100 ppm, Maximalwert 150 - 250 mg/L
Nachweis: Kolorimetrische Bestimmung von Chlorid - cf. Detaillierte Hinweise zur Bestimmung der Chloride sind auf der Seite "Physikalisch-chemische Unter-
suchungen im Braulabor" zu finden (siehe hier).
Abb. 25. Natriumchlorid.
In Wasser gelöst "schwimmen" die Ionen Na+ und Cl- (Chlorid) herum. [Quelle]
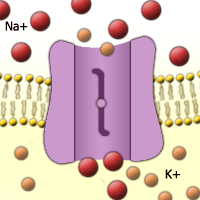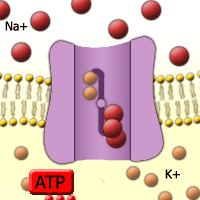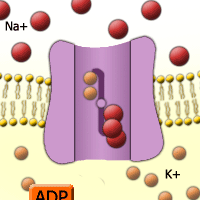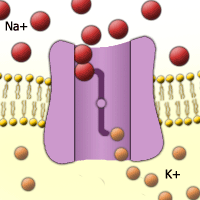
Abb. 26. Natrium-Kalium-Pumpe.
Kalium hat wichtige Funktionen im Hefestoffwechsel. [Quelle]
KALIUM. Kalium kommt in der Natur nur als Kation in Kaliumverbindungen vor. Durch Verwitterungsprozesse wird es aus verschiedenen Mineralien (Feldspate Orthoklas und Mikroklin, Chlormineralien Carnalit und vor allem Sylvit (= KCl) und Silt) herausgelöst und gelangt auf diese Weise in den natürlichen Kreislauf. Es wird auch in grossen Mengen als Düngemittel in der Landwirtschaft eingesetzt, z.B. als Kaliumphosphat K3PO4, Kaliumchlorid KCl und vor allem als Kaliumnitrat KNO3. Kalium spielt als essentielles Element im Stoffwechsel vieler Organismen eine wichtige Rolle (Info).
Auswirkungen Brauprozess:
- Malz bringt grosse Mengen von ca. 300-500 mg/L in die Maische --> Brauwaser sollte nicht mehr als 10 mg/L K+
enthalten
- Kalium übt ab 10 mg/L einen hemmenden Einfluss auf einige Enzyme bei der Würzebereitung in der Maische aus
- Kalium hat aber für die Gärung (Hefestoffwechsel) eine grosse physiologische Bedeutung
- Kalium kann einen salzigen Geschmack auslösen, der in geringer Konzentration aber die Vollmundigkeit steigern kann
Richtwert: 0-5 ppm, Maximalwert 10 mg/L; das Brauwasser sollte also deutlich < 10 ppm Kalium enthalten
Nachweis: Trübungsmessung von Kalium mit Natriumtetraphenylborat - cf. Detaillierte Hinweise zur Bestimmung der
Chloride sind auf der Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).

SULFATE. Sulfate, SO4 2-, die Salze der Schwefelsäure H2SO4, sind wichtige Gesteinsbestandteile. Die häufigsten
sulfathaltigen Mineralien sind Calciumsulfat CaSO4 (Gips, Anhydrit), Magnesiumsulfat MgSO4 (Bittersalz), Barium-
sulfat BaSO4 (Schwerspat) und Natriumsulfat Na2SO4 (Glaubersalz). Grundwässer in sulfatarmen Gesteinen enthalten
üblicherweise bis ca. 30 mg/L Sulfat. Anthropogene Einträge stammen aus der landwirtschaftlichen Düngung (Ammoniumsulfat (NH4)2SO4, Kaliumsulfat K2SO4, Superphosphate) und aus der Deposition von Stäuben und Schwefeloxiden.
Auswirkungen Brauprozess:
- Ca-Sulfate und Mg-Sulfate sind aciditätsfördernd --> pH sinkt --> fördern enzymatische Abbauvorgänge beim Maischen
- Sulfate unterstützen die Proteasen (1 Carboxy- und 2 Aminopeptidasen --> 1 spalten Aminosäuren (= Grundbausteine der Eiweisse) ab, wichtig für
nachfolgendes Hefewachstum in der Startphase der Gärung, 2 dito wie 1, aber erst bei (ungünstigem) pH > 6
- Sulfate verstärken den Bittereindruck des Hopfens und des Hopfenaromas, sie unterstützen die Ausbildung eines
trockenen, bitteren Aromas
- Malz und Hopfen bringen ebenfalls Sulfate in die Maische, aber der Sulfatgehalt des Brauwassers bestimmt die
Sulfatkonzentration in Würze und Bier
- zusammen mit hohen Magnesiumkonzentrationen (> 250 mg/L, Gefahr der MgSO4-Bildung [Bittersalz]) lassen
Sulfate das Hopfenaroma "hart" wirken
- ab 200-250 mg/L --> Hopfencharakter "zupackender und nachhaltiger": vorteilhaft für hopfenbetonte Biere,
störend aber in hellen Lagerbieren süddeutscher oder böhmischer Brauart
Richtwert: 0-200 ppm, Maximalwert 250 mg/L
Nachweis: Trübungsmessung von Sulfaten nach Niederschlag mit Barium-Ionen - cf. Detaillierte Hinweise zur
Bestimmung der Sulfate sind auf der Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).
Abb. 27. Sulfate im Brauwasser.
Sulfate sind nicht unbedingt gerne gesehen im Brauwasser - ausser bei Betonung der Hopfenblume .
Abb. 28. Nitrateintrag in Gewässer und Grundwasser.
Nitrate aus N-Düngern können sehr leicht aus landwirtschaftlich intensiv genutzten Böden ausgewaschen werden. Sie tragen dann häufig in Gewässern und im Grundwasser zur Überdüngung und Überschreitung der Grenzwerte bei (= Eutrophierung).
NITRATE. Durch Düngung bzw. Überdüngung mit N-haltigen Mineraldüngern (u.a. Nitratstickstoff in Calciumnitrat Ca(NO3)2 (Kalksalpeter), Kaliumnitrat KNO3 (Kalisalpeter)) der intensiv genutzten landwirtschaftlichen Flächen gelangt in zunehmendem Ausmasse Nitrat NO3- in das Grundwasser (Info). Nitrat gilt als Indikator für organische Verunreinigungen. Beim Gärungsstoffwechsel kann aus Nitrat NO3- das hefetoxische Nitrit NO2- entstehen.
Auswirkungen Brauprozess:
- je höher die Gesamtsalzkonzentration ist, desto niedriger sollte der Nitratgehalt sein, damit die Hefe nicht
- bei salzarmem, weichem Wasser ist mit Nitrit bereits ab 20 mg/L eine Hemmung des Hefewachstums und
der Gärung zu erwarten
- auch über den Hopfen aus konventionellem Anbau - stark stickstoffgedüngt zur Ertragssteigerung - kann
Nitrat in erheblichen Mengen in die Würze gelangen
- höhere Nitratgehalte > 100 mg/L können einen unangenehmen modrigen Biergeschmack verursachen
Richtwert: 0-20 ppm, Maximalwert 40 mg/L (Nitrit: 0-1 mg/L, maximal 2 mg/L)
Nachweis: Nitrat wird zu Nitrit-Ionen reduziert; diese bilden mit einem geeigneten Reagenz einen orangegelben
Farbstoff, der kolorimetrisch bestimmt wird - cf. Detaillierte Hinweise zur Bestimmung der Nitrate sind auf der
Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).

EISEN. Da Eisen in der Erdkruste (5%) vorkommt, löst es sich aus und dringt somit auch kontinuierlich ins
Grundwasser. Dabei handelt es sich aber um Konzentrationen weit unterhalb gesundheitlich kritischer Bereiche.
Eisen in Ionenform Fe2+ und Fe3+ kommt in natürlicher Umgebung kaum vor: in einer reduzierenden Umgebung
besteht die stabile Form des Eisens im Wesentlichen aus Eisen(III)-oxiden bzw. -oxihydraten (z.B. Fe2O3,
Fe2O3·n H2O); diese Verbindungen sind in Wasser praktisch unlöslich. Eisen wird denn auch nur in geringsten Konzentrationen gemessen
(Bsp. Stadt Zürich: Mittelwert <0.005 mg/L, München <0.02 mg/L. Ausnahmen: Wasserquellen im Unterengadin (Schweiz), z.B. Bonifazius-Quelle in Scuol: Fe > 8 mg/L (Info).
Über eisenhaltige Rohre kann Eisen allerdings trotzdem in das Trinkwasser gelangen. Obwohl die Leitungen meist
mit einer Schutzschicht aus Zink versehen sind, um Korrosion entgegen zu wirken, kann diese sich mit der Zeit
abtragen. Je weniger diese älteren, wasserführenden Installationen gewartet werden, umso leichter kann sich
Eisen herauslösen.
Seine biologische Bedeutung liegt darin, dass es für alle Lebewesen essentiell ist. Für den Menschen ist Eisen ein
lebensnotwendiges Mikroelement, denn es ist vor allem für den Sauerstofftransport des Hämoglobins – der roten
Blutkörperchen - zuständig. Es wird aber primär über die Nahrung und nicht das Trinkwasser aufgenommen.
Auswirkungen Brauprozess:
- kann bereits in geringen Mengen von 1 mg/L negative geschmackliche Auswirkungen hervorrufen
(Fehlaromen: rostig, blutig)
- Eisen wirkt als Katalysator für unerwünschte Oxidationen
- Eisen kann sich als Hemmstoff für gewisse Enzyme auswirken --> Folge: schlechtere Verzuckerung
- Hefestoffwechsel: Fe wird als Spurenelement benötigt (c = < 0.3 mg/L, für Atmungsstoffwechsel [Info]
und Zellsprossung), in höheren Konzentrationen wird die Hefe gehemmt
Richtwert: 0-0.1 ppm, Maximalwert 0.2 mg/L
Nachweis: Kolorimetrische Bestimmung - Eisen(II)-Ionen bilden mit einem Triazinderivat einen violetten
Komplex; durch vorhergehende Reduktion werden Eisen(III)-Ionen miterfasst - cf. Detaillierte Hinweise zur
Bestimmung der Eisen-Ionen sind auf der Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).
KUPFER. Kupfer ist ein essenzielles Element; Hefen benötigen beispielsweise Spuren von Kupfer im
mitochondrialen Atmungsstoffwechsel. Die geochemische Mobilisierung von Kupfer ist gering und daher
sind die Kupferkonzentrationen in Gewässern niedrig. Kupfer fand auch Verwendung als Wasserleitungs-
rohre (gute Korrosionsbeständigkeit, relativ geringe Toxizität). Mit erhöhten Kupferkonzentrationen in
Trinkwasser ist im pH-Bereich unterhalb von 7.4 zu rechnen.
Auswirkungen Brauprozess:
- Kupfer wirkt als Katalysator für die unerwünschte Bieroxidation
- in höheren Konzentratonen kann es einige Hefeenzyme hemmen und somit die Gärung negativ beeinflussen
Richtwert: 0-1 ppm; Maximalwert 2 mg/L
Nachweis: Kolorimetrische Bestimmung - Kupfer(II)-Ionen bilden im ammoniakalischen (alkalischen) Bereich
mit Cuprizon einen blauen Komplex - cf. Detaillierte Hinweise zur Bestimmung der Kupfer-Ionen sind auf der
Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).
ZINK. Viele natürliche Gesteinsarten enthalten Zink in unterschiedlicher Menge. Der durchschnittliche Anteil in der Erdkruste beträgt 70 mg/kg (Trocken-gewicht) und variiert zwischen 10 und 300 mg/kg. Durch die natürliche Verwitterung von Gesteinen durch Wind und Wasser wird ein geringer Teil des Zinks ständig bewegt und in die Umwelt transportiert. Natürliche Zinkkonzentrationen im Wasser liegen meist um 0.05 ppm. Zink ist ebenfalls ein essenzielles Element; Hefen benötigen beispielsweise Spuren von Zinkionen für eine optimale Fermentation (im Konzentrationsbereich < 0.05 ppm). Für die Wasserversorgung wichtig sind die verzinkten Stahlrohre für die Hausinstallation. Für den Menschen und die Tierwelt ist Zink nach dem Eisen das zweitwichtigste Spurenelement: Zink ist Bestandteil von über 200 Enzymen!
Auswirkungen Brauprozess:
- ist von grosser physiologischer Bedeutung für die Zellvermehrung der Hefe und somit für die Gärung.
Bei Zinkmangel kommt es zur schleppenden Hefevermehrung, zu schleppender Gärung und zur unvoll-
ständigen Reduzierung des Diacetyls
- Kupfer wirkt als Katalysator für die unerwünschte Bieroxidation
- in höheren Konzentrationen kann es einige Hefeenzyme hemmen und somit die Gärung negativ beeinflussen
- Fehlaromen bei höheren Zinkkonzentrationen --> adstringierendes Mundgefühl
Richtwert: 0.1-0.5 ppm; Maximalwert 0.5 mg/L
Nachweis: Kolorimetrische Bestimmung - Zink-Ionen bilden bei pH 8.5 – 9.5 mit Zincon einen Farbkomplex
- cf. Detaillierte Hinweise zur Bestimmung der Kupfer-Ionen sind auf der Seite "Physikalisch-chemische Untersuchungen
im Braulabor" zu finden (siehe hier).
Abb. 29. Eisenbergwerk Gonzen [Info].
In unmittelbarer Nachbarschaft zur MUG-Mikrobrauerei wurde bis 1966 Eisen abge-baut. Eisenoxide in direktem Kontakt mit Wasser cf. hier. [Quelle]

Abb. 30. Kupfer wird als Kupfer-Ion Cu2+ aktiv. [Quelle, mod.]

2.10. Kenngrösse 9: Die elektrische LEITFÄHIGKEIT des Wassers
2.10.1. Was versteht man unter "elektrischer Leitfähigkeit"? Info
Wasser = H2O ? Trinkwasser ist wohl eines der reinsten Lebensmittel überhaupt. Die restlichen Bestandteile bestehen aus einer Vielzahl von gasförmigen, gelösten oder partikulären Stoffen in unterschiedlichen Konzentrationen. Dies sind vor allem Mineralstoffe und Ionen wie Kalzium, Natrium und schliesslich organische Teile wie Mikroorganismen oder kleinste Mengen (Spurenstoffe) an Huminsäuren aus unserer Umwelt.
Leitfähigkeit. Die Eignung verschiedener Stoffe zum Leiten von Strom wird durch die Zahl und Beweglichkeit der freien Ladungsträger in ihnen bestimmt. Da die Leitfähigkeit, also die Beweglichkeit freier Ladungsträger, von der Temperatur abhängig ist, wird die Leitfähigkeit bei einer Temperatur von 25°C angegeben. Reines Wasser leitet den elektrischen Strom so gut wie gar nicht. Wer sind nun aber diese "Ladungsträger" im Wasser?
Die elektrische Leitfähigkeit (eLF) wässriger Proben liegt in der Fähigkeit der im Wasser gelösten positiv geladenen Ionen wie Calcium-Ionen Ca2+, Natrium-Ionen Na+, Kalium-Ionen K+, Magnesium-Ionen Mg2+ oder negativ geladenen Ionen wie Chlorid-Ionen Cl-, Karbonat-Ionen CO3 2-, Hydrogenkarbonat-Ionen HCO3 -, Sulfat-Ionen SO4 2-, Nitrat-Ionen NO3 - u.a. Ionen, elektrischen Strom zu transportieren.
Die Leitfähigkeit des Wassers erhöht sich durch Erhitzung. Je höher die Temperatur der zu messenden Probe, desto höher die Leitfähigkeit. Proben sollten daher immer bei gleichbleibender Temperatur (zum Beispiel 20°C) durchgeführt werden.
Masseinheit eLF. Die elektr. Leitfähigkeit wird in Siemens pro Meter (S/m), meist aber in Mikrosiemens pro Zentimeter [μS/cm] angegeben (Ein Siemens entspricht dem Kehrwert von einem Ohm, 1 S = 1/W = 1 W-1. Info zur Erklärung). Gemessen wird der Wert mit einem Leitwertmessgerät (Info 1, Info 2 - Gerätewahl). Die elektrische Leitfähigkeit wird in Siemens pro Meter (S/m) gemessen.
Messtechnik: Das Leitfähigkeits-Messsystem besteht immer aus einer Leitfähigkeitsmesszelle, einem Temperaturfühler/-sensor und einem Leitfähigkeits-messgerät. Die Leitfähigkeitsmesszelle besteht aus 2 Elektroden, an denen eine Wechselspannung angelegt wird und die in eine Lösung getaucht werden. Gemessen wird der elektrische Stromfluss zwischen den beiden Elektroden und je nach Anwendungsbereich wird die Leitfähigkeit (S/m, μS/cm) oder der Widerstand (Kehrwert der Leitfähigkeit) gemessen. Da die Leitfähigkeit stark temperaturabhängig ist, muss bei jeder Messung die Temperatur der Probe gemessen und kompensiert werden (Info).
2.10.2. Was bedeuten die gemessenen Leitfähigkeitswerte?
Interpretation. Das Leitvermögen von Wasser ist ein guter Massstab für die Menge der in ihm gelösten Salze: Je grösser diese Salzmenge bzw. der beim Lösen entstandenen Ionen, z.B. NaCl (fest) + Wasser --> gelöste Na+ und Cl- -Ionen, desto besser leitet das Wasser den Strom. Mit dem Leitfähigkeitswert, der einen sog. Summenparameter darstellt, lässt sich auf Menge der im Wasser gelösten elektrisch geladenen Teilchen in [ppm parts per million] schliessen. Dabei bedeutet ppm "einTeilchen pro eine Millionen Wassermoleküle".
Der Referenzwert wird dabei in Mikrosiemens pro cm [μS/cm] gemessen und in der Folge umgerechnet: dabei entspricht 2µS etwa 1 Teilchen pro einer Million Wassermoleküle. Der sehr einfach und schnell zu erfassende Leitfähigkeitswert ist keine chemische Analyse des Wassers nach seinen genauen Inhaltsstoffen, die im Wasser gelöst vorliegen. Aber er gibt Aufschluss darüber, wie viele Teilchen absolut gemessen im Wasser enthalten sind. Auch gibt es Stoffe (Hormone, Fungizide, Pestizide), die zum Teil keinen Strom leiten und damit vom Mikrosiemenswert nicht erfasst werden können. Dennoch ist klar, dass ein Wasser mit einem sehr niedrigen Mikrosiemenswert auch sehr sauber ist. Jede Veränderung gegenüber dem Normalwert bedeutet auch, dass zusätzlich Stoffe ins Wasser gelangt sind.
Leitfähigkeit und Wasserhärte. Die Leitfähigkeit des Wassers sagt mit guter Annäherung auch etwas über die Wasserhärte aus. Das Messergebnis der Leitfähigkeit des Wassers durch 10 dividiert ergibt den deutschen Härtegrad, dividiert durch 20 den französischen. Wasser mit einem Wert von 0-140 µS/cm gilt als weich, während man bei einem Wert von über 840 µS/cm von sehr hartem Wasser spricht.
Beispielswerte.
Wässrige Proben: Reinstwasser 0,05 bis 0,1 µS/cm, destiliertes Wasser < 20 μS/cm, Regenwasser 5 - 30 μS/cm, Grundwasser 30 - 2'000 μS/cm, Trinkwasser 250 - 1'000 μS/cm (z.B. Fontnas: 213-305 μS/cm, Zürich: 295 μS/cm, St.Gallen: 304 μS/cm, München: 450 μS/cm, Berlin: 756 μS/cm), normales Mineralwasser 400 - 2'000 μS/cm, Teewasser 1'180 μS/cm, Fluss-/Seewasser 1'000 - 5'000 µS/cm, Industrielles Abwasser 5'000 μS/cm, Meerwasser 45'000 - 55'000 μS/cm, 1 mol/L NaCl (= 58.44 g Kochsalz) 85'000 μS/cm.
Getränke: Milch, Bier, Wein 1'000 - 5'000 µS/cm.
Brauprozess: Maische 2'600 - 4'1000 µS/cm.
Grenzwerte für Trinkwasser: EU-Richtlinie 400 μS/cm, WHO für Krisengebiete 750 μS/cm, Schweiz 800 μS/cm, Deutschland 2'790 μS/cm, Österreich 2'500 μS/cm.
2.10.3. Maische, Fermentation, Bier und Leitfähigkeitsmessungen
Teilchen im Bier. Mit dem Leitfähigkeitswert, der einen sog. Summenparameter darstellt, lässt sich auf Menge der im Wasser gelösten elektrisch geladenen Teilchen messen. Was für "Teilchen" könnten das z.B. im Brauwasser, in der Maische oder im fertigen Bier sein?
-
Brauwasser: alle Ionen, also alle Teilchen, die eine positive oder negative elektrische Ladung tragen, tragen zur Leitfähigkeit bei. Aufschluss darüber, um welche Teilchen es sich handeln könnte, gibt eine Wasseranalyse: siehe z.B. hier, also z.B. Ca2+, Mg2+, Cl-, NO3-, SO4 2-, Karbonationen CO3 2- , Hydrogenkarbonationen HCO3- u.a wie Na+, Proteine/Aminosäuren etc. Diese Ionen zusammen ergeben bei diesem Beispiele eine durchschnittliche Leitfähigkeit von 300 μS/cm --> alle diese geladenen Teilchen finden sich später auch in der Maische und natürlich im fertigen Bier.
-
Maische: Brauwasserteilchen plus Phosphate, Aminosäuren, Proteine, organische Säuren.
-
Bier: Brauwasserteilchen plus Maischeteilchen plus Hefeinhaltsstoffe (aus Hefezersetzung, Hefenährlösung für Hefestarter).
Leitfähigkeitswerte Brauprozess (eigene Messwerte).
- Braurezept:
- Brauwasser: Quellwasser Haberbündtli-Quelle Wartau = Trinkwasser der DKGF Fontnas. pH = 7.68, LF = 212 μS/cm
- nach pH-Absenkung auf pH 5.2 mit Milchsäure:
- Maische:
Einmaischen Rasten:
- Anstellwürze:
- Hauptgärung: Tag 1: Tag 2:
- Nachgärung:
- fertiges Bier:
Auswertung/ Kommentar: xxx
Einfluss von TDS auf Struktur/Geschmack von Bier.
Der TDS-Wert (total dissolved solids - Summe aller anorganischen und organischen gelösten Stoffe, meist gelöste Salze, aber auch Feststoffe) sagt auch etwas über die Fähigkeit der Mineralien aus, das Bier zu "würzen", d.h. diese können sich als Geschmacksträger wirksam zeigen. Der TDS-Gehalt im Wasser (als [ppm] oder [mg/L]) wird durch die üblichen Leitfähigkeitsmessgeräte über den gemessenen Leitfähigkeitsmesswert in µS/cm umgerechnet nach der Formel Anzeigewert TDS (in [mg/L]) = Leitfähigkeit (in [µS/cm] x C.tds (Umrechnungsfaktor), wobei für den Faktor C.tds häufig ein gemittelter Standardwert von 0,67 eingesetzt wird (C.tds-Werte: 0.49 NaCl, 0.67 Na2SO4, 0.74 CaSO4, 0.91 NaHCO3, 0.50 einwertige Salze mit 2 Ionenarten (NaCl, KCl u.ä.) und natürliche Wässer/Oberflächenwässer, Trinkwasser; 0.65-0.70 Salzkonzentration von wässrigen Düngerlösungen).
Der mineralische Gesamtgehalt verleiht dem Bier eine Geschmacksstruktur, die als weich, mittel oder kräftig umschrieben werden kann.
An 3 praktisch identischen Bierstilen bezüglich OG und Rezept kann der TDS-Einfluss aufgezeigt werden:
- Böhmisches Pilsner: hopfenaromatisch, sanfte Bitterkeit, malzbetont, sehr vollmundig, mild-weicher Abgang.
TDS 50 ppm (Ca2+: 7, HCO3-: 16)
- Deutsches Pilser (Pilsener, Pils): mehr wahrnehmbare Hopfenbittere, angenehm herber Antrunk, mittlerer Körper, recht trockener Abgang.
TDS 419 ppm (Ca2+: 77, HCO3-: 295)
- Dortmunder Export: starke Hopfenbittere, vollmundig, robust, reicher Malzcharakter und feste, trockene Bitterkeit.
TDS 1'000 ppm (Ca2+: 230, HCO3-: 235)
--> Schlussfolgerung: Karbonat-hartes Wasser betont Hopfenbittere, extrem weiches Wasser unterdrückt Hopfenbittere, oder in der alten Brauerweisheit "Weiches Wasser frisst Hopfen".
2.10.4. Bestimmung der Leitfähigkeit und der Teilchenzahl
Die elektrische Leitfähigkeit wird mit Leitfähigkeitsmessgeräten bzw. Leitfähigkeitssensoren in wässrigen Lösungen gemessen. Die gemessene elektrolytische Leitfähigkeit ist ein Summenparameter für gelöste, dissoziierte Stoffe; daher kann aus der gleichen Messung auch auf die Teilchenzahl geschlossen werden.
Diese Geräte werden als TDS-Messgeräte bezeichnet (TDS = Total Disolved Solids). Ein TDS Messgerät misst über die elektrische Leitfähigkeit wie viel gelöste Feststoffe (z.B. Mineralien, Salze, Metalle, Medikamentrückstände, Bakterien) im Wasser enthalten sind. Der Messwert macht keine Aussage darüber welche
Stoffe im Wasser gelöst sind. Es ist ein rein quantitatives Mass für deren Anzahl. Üblicherweise wird der TDS-Messwert in ppm = parts per million angegeben: z.B. bedeutet ein Wert von 10 ppm, dass auf 1 Million Wassermoleküle etwa 10 Moleküle gelöster Feststoffe kommen.
Die Messung der elektrischen Leitfähigkeit erfolgt über eine Widerstandsmessung. Im einfachsten
Fall besteht die Messzelle aus zwei metallischen Elektroden, zwischen denen eine Wechselspannung
angelegt wird. Je mehr Ionen die Messlösung enthält, desto grösser ist der zwischen den Elektroden
fliessende Strom. Mit dem Ohm’schen Gesetz wird daraus die Leitfähigkeit berechnet. Die Einheit der
elektrischen Leitfähigkeit ist S/cm bzw. μS/cm. Die Messung kann nun erfolgen durch
-
Leitfähigkeitsmessgeräte: decken meist verschiedene Messbereiche ab, z.B. 0-2'000 μS/cm,
0-20 mS/cm, 0-100 mS/cm, Bsp. hier). In einfacher Ausführung werden sie meist als Leitfähigkeits-
tester oder Leitwert-Messstick bezeichnet (Bsp. hier, hier)
Detaillierte Anleitungen zur Leitfähigkeits-/TDS-Bestimmung sind auf der Seite "Physikalisch-chemische
Untersuchungen im Braulabor" zu finden (siehe hier).
Direkt zur PDF-Anleitung "Bestimmung des Leitfähigkeits-/TDS-Wertes" geht es hier.
Abb. 32. Leitfähigkeits-Messgeräte.
Links: Messung der Leitfähigkeit LF [mS/cm, μS/cm].
Rechts: kombiniertes LF/TDS-Gerät für zusätzliche TDS-Messung bzw. Umrechnung in [ppm].
2.11. Kenngrösse 10: Der gelöste SAUERSTOFFGEHALT (z.B. der Anstellwürze)
2.11.1. Was versteht man unter "gelöstem Sauerstoffgehalt"?
Bedeutung. Sauerstoff kommt als zweiatomiges Gas O2 elementar in der Luft zu
etwa 20.95 Vol.-% und zu 23.16 Gew.-% vor (Hinweis: meist wird der O2-Gehalt als
Vol.-% angegeben) und, abhängig vom Druck und Temperatur, gelöst in wässriger
Umgebung vor (Angabe z.B. in [mg/L], Info). Für (fast) alle Lebewesen auf der Erde
und im Wasser ist es das wichtigste Element: Die meisten Organismen benötigen
Sauerstoff für die aerobe Atmung und den übrigen Stoffwechsel. Darüber hinaus
ist er für alle Verbrennungsvorgänge (= "zivilisatorisch-industrieller Stoffwechsel")
unentbehrlich. Gebunden kommt er in vielen Molekülen vor, z.B. in Wasser H2O zu
89 Gew.-%. Gelöster Sauerstoff ist für das überleben von Organismen in wässriger
Umgebung notwendig (Umweltgewässer, Nährlösungen). Die Mehrzahl der Makro-
und Mikroorganismen benötigt zum Überleben und zur Vermehrung eine Mindest-
konzentration an Sauerstoff. Nicht verschmutzte Gewässer enthalten zwischen 8 mg
(25 °C) und 12 mg O2 pro Liter (6 °C).
Gelöster O2. Der Sauerstoff tritt mittels Diffusion (Info1, Info2) aus der
Atmosphäre mit 20.95% in das Wasser ein. Die Transferrate hängt vomLuftdruck
und der Flüssigkeitsoberfläche ab. Bewegungen wie Wind, Wellen oder
Schütteln bzw. Schlagen/Rühren mit einem Braupaddel unterstützt den
Sauerstoffübergang ins Wasser. Der wichtigste Parameter für die O2-Löslich-
keit im Wasser ist die Temperatur. Bei 10 °C lösen sich ca. 11 mg O2/L , bei
30 °C ca. 7.5 mg O2/L (Sättigungskonzentration bei 760 mm Hg/ 1013.25 mbar).
Generell gilt: bei niedrigen Temperaturen ist die O2-Löslichkeit in wässrigen
Medien grösser als bei höheren
(cf. Sauerstoff-Sättigungswerte).
2.11.2. Wachstum von Mikroorganismen (Wachstumsphasen)
Mikroorganismen und O2. Mikroorganismen bauen energiereiche
organische Verbindungen wie Kohlenhydrate zur Energie- und
Baustoffgewinnung unter Sauerstoffverbrauch ab (= aerober Stoffwechsel
mit aerober Atmung, cf. "Biologie der Gärung" > Energiestoffwechsel hier),
z.B. Zuckerabbau:
C6H12O6 + 6 O2 -- Mikroorganismen--> 6 CO2 + 6 H2O + Energieträger (32 ATP).
Mikroorganismen, die zur Gärung befähigt sind (Info, und hier), können auch
ohne Sauerstoff einen minimalen Stoffwechsel mit allerdings wesentlich
geringerer Energieausbeute betreiben, z.B. alkoholische Gärung:
C6H12O6 ---Gärmikroorganismen---> 2 C2H5OH + 2 CO2 + Energie (2 ATP).
Hefen sind fakultativ anaerob, d.h. Hefen können mit Sauerstoff (aerob,
griech. aer "Luft") mittels der Zellatmung als auch ohne Sauerstoff (anaerob)
mittels der Gärung Energie gewinnen (Abb. 34).
Bei Zuckerhefen (Saccharomyces) reicht der Gärstoffwechsel gerade
zum Überleben aus (und für die für den Menschen interessante
Alkoholproduktion), aber nicht für die Fortpflanzung/Vermehrung.
Beim Anstellen (= Animpfung) der sterilen Anstellwürze mit Bierhefen
muss deshalb diese Bierwürze zunächst mit Sauerstoff angereichert
werden, damit überhaupt eine kräftige Hauptgärung stattfinden kann.
Diese erste Phase im Gärzyklus, deren Ende mit dem klassischen Begriff "Ankommen" bezeichnet wird (bei obergärigen Hefen innerhalb von 6 bis 8 Stunden nach der Animpfung, bei untergärigen Hefen bis 12 Stunden), führt zu einer asexuellen Vermehrung der Anzahl der gärfähigen Hefen durch Sprossung (Knospung: Ausstülpung der Tochterzelle mit dem identischen Erbgut DNA im Zellkern; siehe hier).
Detaillierter betrachtet durchläuft die Hefe bei der
Zellvermehrung zunächst 3 Phasen, die O2-abhängig
(aerob) sind (Abb. 35):
-
Phase 1 = Latenz- oder Induktionsphase (auch
lag-Phase, Anlaufphase): Stoffwechselaktivierung
der bereits vorhandenen Hefezellen, Anpassung
an die neuen Umgebungsbedingungen wie
Temperatur, pH-Wert, Salzgehalt u.a.
-
Phase 2 = Beschleunigungsphase: laufende
Zunahme der Geschwindigkeit der Zellteilung.
-
Phase 3 = Exponenzielle Wachstumsphase, bzw.
logarithmische Vermehrungsphase (log-Phase):
Hefeteilung mit der höchsten Wachstumsrate,
je nach Hefestamm alle 90 bis 120 Minuten.
Die folgenden 3 Phasen sind die eigentlichen
Gärphasen, d.h. O2-unabhängig (anerob):
-
Phase 4 = Verzögerungsphase: die Zellteilungen
und damit die Hefezellvermehrung verlangsamt
und wird abgeschlossen (der O2-Gehalt ist ver-
braucht).
-
Phase 5 = Stationäre Phase: Beginn der Haupt-
gärung; die Zellen haben das Wachstum ein-
gestellt, die Zellzahl bleibt konstant, als Überlebensstrategie läuft nun die Energiegewinnung ohne Sauerstoff über die alkoholische Gärung ab.
-
Phase 6 = Absterbephase: Ende der Hauptgärung; die Zahl der aktiven, lebenden Hefezellen nimmt ab, die meisten Hefezellen sinken im Gärgefäss ab und sind im Hefesediment am Boden komprimiert; einige Hefezellen sind auch noch nach Monaten lebend und können "wiederbelebt" werden.
Konsequenzen aus dem Wachtums- und Vermehrungsverhalten der Hefezellen:
-
Hefezellen müssen zur Stimulierung ihres Zellwachstums, ihrer Fortpflanzung und Zellvermehrung belüftet werden, um genügend Sauerstoff in der Nährlösung/Anstellwürze vorzufinden.
-
Positiver Sauerstoffgehalt steuert die Zellvermehrung, fehlender O2-Gehalt aktiviert die alkoholischen Gärprozesse.
-
Die alkoholische Gärung läuft nur in O2-Abwesenheit ab, also unter anaeroben Verhältnissen.
Exkurs Profibrauereien: Nach der Hauptgärung ist Sauerstoff im Bier gar nicht mehr erwünscht: Um die Haltbarkeit von Bier zu verlängern, muss im Anschluss an die Würzebelüftung der verbleibende Sauerstoff entfernt und bis zur Abfüllung auf möglichst niedrigem Niveau gehalten werden.
O2 verursacht Oxidationsschäden, die zum Aromaabbau beitragen, die sich besonders während der Lagerung von Bier bemerkbar machen. Sauerstoff kann an zwei Stellen in das Endprodukt gelangen: 1. während der Abfüllung, 2. im Flaschenkopf durch unvollständiges Aufschäumen. Auch nach dem Verschluss mit herkömmlichen Kronkorken gelangen 1 bis 2 ppb O2 (parts per billion = deutsch "Teile pro Milliarde" = 1 Milliardstel = 10^-9 = 1/1000 ppm, z.B. 1 ppb = 0.001 mg/L) pro Tag in die Flasche. Über einen Zeitraum von 3 Monaten kann dies zu einem Sauerstoffeintritt von bis zu 180 ppb (= 0.18 ppm = 0.18 mg O2/L) führen. Branchenübliche Sauerstoffgehalte: Fermentation < 10 ppb, Filtration 5-50 ppb, helles Bier nach Filtration 10-50 ppb, Menge gelöster O2 in Flasche 20-50 ppb, in Dose 30-60 ppb, im Endprodukt 40-150 ppb.
Solche Fakten sind für den Heimbrauer interessant, sauberes O2-armes Abfüllen z.B. mit der BeerGun (cf. hier) ermöglichen ihm ebenfalls ein fast O2-freies Befüllen der Bierflaschen, welche O2-Messungen im Bier überflüssig machen (ausser aus Neugier ....). Hingegen ist die richtige Belüftung vor dem Anstellen auch für den Heimbrauer entscheidend! Weitere wichtige Massnahmen zur Verhinderung von oxidativen bierschädigenden Vorgängen: siehe "Physikalisch-chemisches Braulabor > 3.10. Bestimmung Sauerstoffgehalt", bzw. direkt hier.
Abb. 33. Temperaturabhängige Löslichkeit von Sauerstoff O2 in Wasser (Sättigungswerte für 1013 mbar für 20.95 Vol.-% O2).
O2 ist in Wasser physikalisch gelöst, der Sättigungswert in Wasser hängt vor allem vom Partialdruck des Sauerstoffs in der Luft ab und von der Temperatur. [Quelle: mod. hier]

Abb. 34. Hefestoffwechsel.
Aerober Atmungsstoffwechsel (oben) und anerober Gärstoffwechsel (unten) von Hefen. Die Energieausbeute ist bei Gärungen gering (--> eine Art "Überlebensstoffwechsel").

Abb. 35. Wachstum von Mikroorganismen mit 4 Hauptphasen.
1: Anlaufphase (lag-Phase); 2: Beschleunigungsphase; 3: exponenzielle Phase (log-Phase); 4: Verzögerungsphase (Übergangsphase); 5: stationäre Phase; 6: Absterbephase (Absetzphase).
Die in den Reagenzgläser hellrot dargestellten Mikroorganismen symbolisieren die sich noch aktiv vermehrenden Zellen.
Abb. 36. Hinweise zur Belüftungstechnik und Belüftungsdauer zur Erreichung einer bestimmten O2-Konzentration.
(Quelle inkl. Videolinks: cf. Braulabor 21 - Hefewachs- tum und Gärung hier).
2.11.3. Belüftungsverfahren zum Eintrag von ausreichend Sauerstoff für die Hefevermehrung
Optimaler Sauerstoffgehalt.
Der zum Hefezellwachstum- und Zellvermehrung nowendige Sauerstoff kann auf verschiedenste Weise in das Nährmedium bzw. in die Anstellwürze gebracht werden
(cf. Abb. 36):
-
Schütteln des Gärbehälters
-
Rühren mit Kochlöffel
-
Begasen mit Luftsauerstoff
-
Begasen mir reinem O2.

2.11.4. Bestimmung des O2-Gehalts in wässrigen Medien (Gelöstsauerstoff)
Physikalisch gelöster Sauerstoff O2 ("Gelöstsauerstoff") kann mit verschiedenen Sauerstoffsensoren gemessen
werden (Info). Grundprinzip der meist elektrochemischen Bestimmung der Sauerstoffkonzentration sind
membranbedeckte elektrochemische Sensoren. Die Hauptbestandteile des Sensors sind die sauerstoffdurchlässige
Membran, die Arbeitselektrode, die Gegenelektrode, die Elektrolytlösung und eventuell eine Referenzelektrode.
Zwischen Goldkathode und Anode, welche entweder aus Blei oder Silber besteht, liegt eine Spannung an, die
Sauerstoff elektrochemisch reagieren lässt. Der entstandene Stromfluss ist um so höher, je höher die Konzentration
an Sauerstoff ist. Messgrösse ist der im Sensor fliessende Strom, welcher nach erfolgter Kalibrierung in die
Konzentration des gelösten Sauerstoffs umgerechnet werden kann.
Mehr Details zur Messtechnik: cf. unter "Physikalisch-chemisches Braulabor > 3.10. Bestimmung des gelösten
Sauerstoffgehalts", hier.
Für den Heimbrauer hat sich das preisgünstige System von EXTECH ExStik DO600 bewährt (Info, Video).
Detaillierte Informationen zur Bestimmung der "Gelöstsauerstoffs" sind auf der Seite
"Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).
Hier geht es direkt zur PDF-Anleitung "Bestimmung des gelösten Sauerstoffs"
Abb. 37. Bestimmung des Gelöstsauerstoff
mit dem ExStik DO600.
2.12. Kenngrösse 11: Die MIKROBIOLOGISCHEN Kenngrössen
2.12.1. Welche mikrobiologischen Kenngrössen sind für das Brauwasser von Bedeutung?
Bakterien und andere Mikroorganismen wie Einzeller, Pilze/Pilzsporen oder Mikroalgen kommen überall vor, so natürlich auch im Wasser/Trinkwasser. Nur sehr wenige Bakterien sind tatsächlich krankheitserzeugend. Andere Bakterienarten sind dagegen völlig unschädlich. Trinkwasser muss nicht unbedingt keimfrei sein – es muss nur frei von pathogenen Bakterien sein. Eine geringe Zahl harmloser Bakterien ist völlig normal, natürlich und unschädlich.
Bakteriologische Wasser-Hygiene-Kontrolle
Die bakteriologischen Hygiene-Untersuchungen prüfen Wasserproben auf die Belastung durch Bakterien. Häufig lässt sich eine bakterielle Belastung des Wassers mit dem einfachen Auge erkennen: trübliches Wasser, Geruch, Farbe. Dies trifft sehr häufig bei belastetem Wasser auf, aber auch klares Wasser kann Keime enthalten. Zum Beispiel sieht die Trinkwasserverordnung in den meisten Ländern eine Menge von 0 Escherichia coli-Bakterien pro 100mL Wasser vor, aus dem Grund, weil Coli-Bakterien Durchfälle, Magenschmerzen und weitere Vergiftungssymptome verursachen können, primär aber als Indikator für weitere bakterielle pathogene Keime und Parasiten fungieren. Für die Trinkwasserhygiene und damit auch Brauwasser ist der wichtigste Darmbewohner das Bakterium "Escherichia coli" (E. coli, Bacterium coli, "Kolibakterien", allg. Darmbewohner Enterobacteriaceae) in Konzentrationen von
10^5 - 10^9 (100'000, 1000 000 000)/g Fäkalien. Daneben kommen noch viele weitere Mikrorganismen vor (Info), von denen vor allem die Enterokokken, Pseudomonas aeruginosa, Clostridium perfringens und Legionella spec. weitere wichtige Hygieneparameter sind. Stehendes Wasser, hohe Bakterienkonzentrationen wie in Wasserfiltern und Ablagerungen in Leitungen bilden besondere Risiken für eine Verkeimung und eine nachfolgende Infektion.
Enterokokken: Darmkeime, die vor allem auf länger zurückliegende Verunreinigungen mit Fäkalien hinweisen. Sie können unter anderem Wundinfektionen und Harnwegsinfekte verursachen.
Pseudomonas: Pseudomonas aeruginosa ist ein Keim, der sich häufig auch in stehenden Abwässern findet. Er kann teilweise schwere Infektionen auslösen. Das betrifft aber fast ausschließlich Menschen mit eingeschränktem Immunsystem.
Clostridien: Clostridien sind ebenfalls Darmkeime. Ein einzelner Stamm, nämlich Clostridium perfringens, kann den sogenannten Gasbrand auslösen, eine extrem gefährliche Infektion von Weichteilgewebe. Für C. perfringens gibt es in den Trinkwasserverordnungen deshalb ein eigenes, genau geregeltes Nachweisverfahren.
Legionellen: Legionellen sind sehr gefährliche Erreger, die sowohl Magen-Darm-Krankheiten als auch häufig tödlich verlaufenden Lungenentzündungen auslösen können. Dafür müssen sie aber durch Zerstäubung des Wassers in die Lunge geraten.
mikrobiologische Trinkwasserqualität = Brauwasser
Grundsätzlich sollte das Brauwasser die von der jeweiligen Trinkwasserverordnung vorgegebenen sensorischen, physikalisch-chemischen und mikrobiologischen Anforderungen genügen. Die brauwasser-spezifischen Anforderungen chemisch-physikalischer Natur sind unter den Kenngrössen 1 - 10 charakterisiert worden (cf. oben Pkt. 2.2 - 2.11). Aber auch an die mikrobiologische Beschaffenheit des Wassers werden zurecht hohe Anforderungen gestellt. Die Mehrzahl der im Wasser vorkommenden Bakterien sind nicht pathogen, also keine Krankheitserreger. Dennoch können die oben erwähnten, meist aus tierischen oder menschlichen Fäkalien stammenden Mikroorganismen vorkommen, die zu Krankheiten führen können. Daher sollten diese Indikatorkeime wie E. coli und Enterokokken nicht nachweisbar sein und gemäss den meisten Trinkwasserverordnungen in 100 mL Trinkwasserprobe kein einziger Keim nachweisbar sein.
Aufbereitung von Trinkwasser
Im allerbesten Falle muss das Trinkwasser nicht aufbereitet werden, da es z.B. direkt
als Quellwasser gefasst und kontroliert werden kann.
Häufig wird Grundwasser aus Grundwasserschutzzonen gepumpt. In der Schweiz kann
das Grundwasser vielerorts ohne jegliche Aufbereitung als Trinkwasser genutzt werden.
Für diese natürliche Qualität sorgt die Filterfunktion des Bodens, die das Grundwasser
zuverlässig reinigt und ebenso die Beseitigung von Krankheitserregern sorgt. Die
Grundwasserschutzzonen fungieren sozusagen als natürliche Aufbereitungsanlagen,
die das Grundwasser auf seinem Weg zur Trinkwasserfassung reinigen (Info CH).
Die Aufbereitung von Grundwasser ist hier dargestellt.
Aber Trinkwasser kann bzw. muss je nach Verfügbarkeit auch aus Fluss- und Seewasser
gewonnen werden (z.B. Stadt St.Gallen [Info], Stuttgart [Info]). Die Aufbereitung umfasst
verschiedenste Verfahren, im Wesentlichen zwei Gruppen der Behandlung:
-
Entfernung von unerwünschten Stoffen aus dem Wasser (z. B. Reinigung, Entkeimung/
[z.B. durch Chlorierung, Ozon], Sterilisation, Enteisenung, Entmanganung, Enthärtung,
-
Ergänzung von Stoffen sowie Einstellen von Parametern des Wassers (z. B. Dosierung,
Einstellung von pH-Wert, gelösten Ionen und der Leitfähigkeit) (Info1, Info2, Info3).
Das Beispiel der Bodenseewasseraufbereitung in St. Gallen umfasst mehrere
Stufen:
-
Voroxidation des Seewassers mit Ozon (Desinfektion, Flockenbildung)
-
Zugabe von Eisen-III-Chlorid (Flockenbildung)
-
Schnellfiltration über Quarzsand und Bims (Entfernung von Trübstoffen/
Flocken)
-
Zwischenoxidation mit Ozon (Abtöten der Mikroorganismen, Abbau von
Schadstoffen)
-
Absorption über Aktivkohlefilter (Entfernung von Schadstoffen).
2.12.2. Abschätzung der "Wasser-Koloniezahlen"
Normales Trinkwasser: Das Trinkwasser wird ja "trinkfähig", also
innerhalb der jeweiligen länderspezifischen Keimgrenzwerte geliefert,
periodisch kontrolliert und kann daher i.d.R. ohne mikrobiologische
Bedenken als Brauwasser genutzt werden; eine spezielle zusätzliche
Behandlung ist nicht notwendig. Zudem wird es ja im Verlaufe des Sudprozesses über längere Zeit (60 - 90 min) zum Sieden gebracht und dadurch sterilisiert.
Chloriertes Wasser: Einzig chloriertes Wasser, d.h Wasser das zur Entkeimung mit Chlor (Cl2), Hypochlorite (z.B. NaOCl), Hypochlorige Säure (HClO), Mono-chloramin (NH2Cl) , Chlordioxid (ClO2) und anderen chlorhaltigen Verbindungen desinfiziert wurde, ist für das Brauen nicht optimal und muss "entchlort" werden. Dies ist beispielsweise für viele US-Hobbybrauer ein notwendiges Übel. Info Info (PDF), Entchlorung Brauwassermit Campden-Tabletten: Info Info Info (Kalium-/oder Natriumdisulfit K2S2O5, Na2S2O5). Reaktionen: 1. bei Anwesenheit von Chlor: Na2S2O5 + H2O --> 2SO2 + 2Na+ + 2OH-; SO2 + 2Cl(*) + 2H2O --> 4H+ + 2Cl- + SO4 2-. 2. Bei Anwesenheit von Chloraminen: 2Na+ + S2O5 2- + 2H2NCl + 3H2O --> 2Na+ + 2SO4 2- + 2Cl- + 2NH4+.
Brauchwasser z.B. für Spülungen: Normales trinkfähiges Leitungswasser enthält immer eine bestimmte Anzahl an mikrobiellen Keimen, die als Gesamt-keimzahl im Wasser, genauer als sogenannte Kolonie bildende Einheiten (KBE) erfasst werden (Info 1, Info 2). Nach der konventionellen Wachstumsmethode auf Agarnährböden werden neben den Indikatorkeimen auch harmlose aerobe mesophile Keime in KBE/mL sowie die Totalzellzahl als Zellen/mL erfasst (Bsp. Kt. Zürich, Info). Stehendes Brauchwasser bildet häufig sich schleimig anfühlende Mikrobenüberzüge (mikrobielle Matten, Biofilme) auf Oberflächen aus, z.B. im Wasserbehälter der Kaffeemaschine oder in der Druckflasche zur Erzeugung von CO2-haltigem Sprudelwasser aus gewöhnlichem Leitungswasser (Info 1, Info 2).
Detaillierte Informationen zur Bestimmung der "Keimzahlen" sind auf der Seite "Physikalisch-chemische
Untersuchungen im Braulabor" zu finden (siehe hier).
Informationen zu Bierschädlingen allgemein und deren Nachweis siehe Bierschädlinge allgemein, Nachweis von
Bierschädlingen.
Direkt zur PDF-Anleitung "Gesamtkeimzahl - KBE aerober mesophiler Keime"
geht es hier.
Anmerkung: Totalzellzahlen im Wasser werden heute immer häufiger nach einem neuen Verfahren,
der sog. "Durchflusszytometrie" bestimmt. Dieses apparativ aufwändige, aber rasche Verfahren
liefert weitaus höhere "Bakterienzahlen" (siehe Info dazu).

Abb. 38. Beispiel einer Grundwasser-Aufbereitung [Quelle].

Abb. 39. Beispiel einer Seewasser-Aufbereitung [Quelle].
Abb. 40. Bestimmung der im Wasser lebenden Bakterien.
Grobabschätzung der Gesamtkeimzahl als KBE - Kolonie bildende Einheiten.
2.13. Kenngrössen 12-14: Weitere wichtige Kenngrössen
2.13.1. Die Iodprobe als qualitativer Stärkenachweis beim Maischen: Ist die Stärke vollständig verzuckert?
Akoholische Gärung durch Hefen bedeutet, dass ein Baustoff (bei Sauerstoffversorgung, aerobe Verhältnisse) primär zum Energieträger wird (bei Abwesenheit von Sauerstoff, anaerobe Verhältnisse). Die Hefe ist ein vielseitiges Lebewesen, das sich sowohl aerob vermehren und Energie gewinnen kann, aber auch bei Abwesenheit von Sauerstoff durch den Trick der anaeroben Energiegewinnung mittels alkoholischer Gärung noch energetisch überleben kann (vgl. Webseite "Biologie der Gärung" hier > insbesondere "Stoffwechsel der Hefen").
Dieser "Rohstoff" ist zunächst Stärke von Pflanzen, bei der Bierherstellung meist Stärke aus Gerste und Weizen. Die Stärke als Vielfachzucker (Polysaccharid, besteht aus langen unverzweigten Glukoseketten [= Amylose, lösliche Stärke] und baumartig
verzweigten Ketten [= Amylopektin, kleisterartige, unlösliche, quellfähige Stärke].
Amylose besteht aus α-Glucosemolekülen, die über eine 1,4-glykosidische Bindung miteinander
verknüpft sind. Es handelt sich um ein lineares Molekül, das sich in einer spiralförmigen Helix windet.
Amylose macht ca. 25% der Stärke aus. Einige Moleküle, wie z. B. Iod, geben mit Amylose Einschluss-
verbindungen. Auf dieser Fähigkeit beruht auch der Nachweis von Stärke (cf. unten).
Amylopektin ist im Gegensatz zu Amylose ein verzweigtes Polysaccharid und macht etwa 75% der
Stärke aus. Die Verzweigung kommt durch zusätzliche, allerdings unregelmässig auftretende
α-1,6-Verknüpfungen zustande. Mit Iod gibt es keine besonderen Verbindungen; deshalb bleibt die
Mischung iodbraun.
Stärke kann also stark vereinfacht als "(Glukose-Glukose- .... -Glukose)n"-Molekül dargestellt werden,
wobei n bei der löslichen Amylose bis ca. 1'000 betragen kann; bei der unlöslichen verzweigten
Amylopektinkomponente liegt n zwischen 62'000 bis 145'000-Traubenzuckereinheiten.
Stärkenachweis:
Die Iodprobe (Iod-Stärke-Reaktion) ist ein chemisches
Verfahren zum Nachweis von Stärke mit Hilfe einer
Iod-haltigen Lösung. Dabei wird meistens entweder
eine Iod-Kaliumiodid-Lösung (syn. Lugolsche Lösung, KI . I2
[Info]) oder eine Iodtinktur (alkoholische Lösung von
elementarem Iod [Info]) eingesetzt, die auf eine feste
Probe geträufelt oder mit einer Probelösung versetzt wird.
Es entsteht die "Iodstärke", eine Einschlussverbindung, die
- je nach Konzentration der verwendeten Iod-Lösung -
eine tiefblaue, blauviolette bis schwarze Färbung aufweist.
Detaillierte Anleitungen zum Stärkenachweis sind auf der Seite
"Physikalisch-chemische Untersuchungen im Braulabor" zu
finden (siehe hier).
Direkt zur PDF-Anleitung "Iodprobe: Nachweis von Stärke" geht
es hier.

Abb. 41. Stärke ist ein Polysaccharid mit der Formel (C6H10O5)n.
Amylose ist der lösliche Stärkeanteil und reagiert mit dem Iodreagenz mit der typischen blau-violetten Farbe (cf. Abb. 41).
Amylopektin ist der mit 70% mengenmässig wichtigere Anteil und besteht aus verzweigten Glukoseketten. Bei der Iodprobe ergibt sich eine schwache Färbung von rötlich bis violett, je nach Stärkeherkunft. Detailstruktur: cf. hier.
Abb. 42. Stärkenachweis mit Iodlösung.
Die in der Stärke vorhandene Amylose besitzt eine helix-förmige Konformation mit einem kanalartigen Hohlraum
in der Mitte. In diesen können sich Polyiodidketten (I3−, I5−, I7−, I9−) einlagern (im Bild: I3-).
Rechte Hälfte Abb.: Struktur der Amylose mit den Glukose-bausteinen.
2.13.2. IBU - Wie bitter ist das Bier?
Hopfen mit Mehrfachwirkung.
Seit etwa dem 9. Jahrhundert wird dem Bier anstatt der Kräuter Hopfen beigegeben, was die "Seele des Bieres", die "Würze des Bieres" bzw. auch das "Salz des Bieres" ausmachen soll. Diese unverzichtbare Bierzutat erfüllt verschiedenste wichtige Funktionen: 1. er verleiht dem Bier den einzigartigen, mehr oder weniger bitteren Geschmack, 2. bringt weitere Geschmacks- und Duftkomponenten für Gaumen und Nase ins Bier, 3. entfaltet konservierende Wirkung (desinfizierend, keimtötend), 4. entfaltet angenehme physiologische Eigenschaften wie schlaffördernd, beruhigend ("Schlummertrunk"), allgemein stoffwechselfördernd (cf. diese Website hier) und zeigt 5. weitere wichtige Wirkungen für den Brauprozess wie Eiweissausscheidung durch die Gerbstoffe beim Würzekochen, reduzierende Wirkung (Aufzehrung des Restsauerstoffs in der Bierflasche) und Schaumverbesserung durch die Iso-Alphasäuren.
Hopfen als Bitterstofflieferant.
In der Regel wird Hopfen beim Würzekochen ("Hopfenkochen") zugefügt, meist in mehreren
Gaben. Die Hauptgabe (60-70%) oder bei Einmalgabe (100%) erfolgt immer zu Beginn des
Kochens (5-10 min nach dem Siedebeginn) - Bitterhopfen mit höheren α-Säurewerten.
Weitere Hopfenzugaben erfolgen meist kurz vor Kochende (ca. 15-20 bis 5 min davor --> geringere Verflüchtigung der für das Aroma verantwortlichen Hopfenöle) und resultieren in einem hopfenintensiven Aroma. Durch das Hopfenstopfen bzw. auch als Kalthopfung bezeichnetes Verfahren - Einbringen des Hopfens in den Lagertank bzw. in die Nachgärung - werden deutlich mehr und besser die leicht flüchtigen Geschmacksaromen bei der kalten Temperatur und durch das Lösungsmittel Alkohol und Kohlenstoffdioxid CO2 aus den wasserunlöslichen Hopfenölen gelöst. Info Hopfenbitterstoffe.
Die Bier-Bittere wird vor allem durch die Isomere der Alphasäure aus dem Hopfen bestimmt, da diese wasserlöslich sind. Durch den Alkohol im fertigen Bier gelangen aber beim Hopfenstopfen auch weitere Bitterstoffe zusätzlich ins Bier. Die Hopfenbittere (Bittereinheiten = BE) wird international in IBU (International Bitter Units, ursprünglich EBU [European Bitterness Unit]) von der European Brewery Convention (EBC) festgelegt und ist eine Masseinheit (Bittereinheit) für den alpha-Säure-Anteil im Bier. Diese Bittere sollte nicht mit der realen Bitterkeit von Bier verwechselt werden, da die gemessene Bitterkeit und die empfundene Bitterkeit nicht identisch sind: neben der objektiven messbaren Grösse bestimmen die Restsüsse und das Hopfenaroma die subjektive Bitterkeitswahrnehmung.

Abb. 43. Richtwerte für die Berechnung der Hopfen-zugabe.
Weitere Bitterwerte für zahlreiche zusätzliche Bierstile siehe z.B hier (allgemein) und hier (deutsche Biere).
Richtwerte für Biersorten.
Die Angaben der Abb. 43/44 können als Richtwerte für die Berechnung der Hopfenzugabe
verwendet werden. Da nicht nur die gemessene Bittere den schmeckbaren Gesamteindruck
ausmacht, ist das Verhältnis von Bittereinheiten zur Stammwürze ebenso zu berücksichtigen
(cf. Abb. 10 der PDF-Anleitung zur IBU-Abschätzung). Entscheidend für den ISU-Wert ist die
Konzentration an Iso-Alpha-Säuren des gebrauten Bieres. So ist eine International Bitterness
Unit (IBU) als 1 Milligram Iso-Alpha-Säuren pro Liter Bier definiert.
Analytische Bestimmung der Iso-Alpha-Säure.
Das übliche Verfahren zur Bestimmung des Iso-Alpha-Säure-Gehaltes im Hopfen und Bier ist
die photometrische Analyse bei einer Wellenlänge von 275 nm. Ein aufwändigeres und genaueres
Verfahren HPCL-Analytik (High Performance Liquid Chromatography, Info 1), Info 2). Beide
Analyseverfahren stehen natürlich dem Heimbrauer nicht zur Verfügung und daher muss er
auf die publizierten Daten (Hopfenanalysen, z.B. Barth-Haas-Group hier, Bsp. Saphir) zugreifen.
Mittels rechnerischer Verfahren kann der theoretische IBU-Bitterwert abgeschätzt werden.
Detaillierte Hinweise, Überlegungen und Anleitung zur Berechnung der Bitterwerte sind auf der Seite "Physikalisch-chemische Untersuchungen im Braulabor" zu finden (siehe hier).
Direkt zur PDF-Anleitung "Berechnung der Bitterkeitswerte" geht es hier.
Abb. 44. IBU-Abschätzung durch Berechnungsverfah-ren: auf Abb. klicken!
Der Heimbrauer kann die IBU-Werte nicht selbst analytisch bestimmen, nur annähernd rechnerisch abschätzen.
2.13.3. EBC/SRM - Welche Farbe hat das Bier?
Mit der Einheit EBC (European Brewery Convention) wird im europäischen Raum die Farbe (genauer: die Farbstärke) von Bier und Bierwürze beschrieben. Der von der EBC festgelegte Wert bezeichnet, wieviel Licht von Bier eines bestimmten Stammwürzegehalts absorbiert wird. In den USA ist die Einheit SRM dominant, welche von der ASBC (American Society of Brewing Chemists) definiert und messtechnisch beschrieben wird (Info).
Wie entsteht die Bierfarbe?
Jedes Bier hat seine eigene Farbe und erlaubt sogar spektralanalytisch eine genau Zuordnung zu einer bestimmten Biermarke (cf. hier). Doch was macht eigentlich die Bierfarbe aus?
Für die Bierfarbe eines Bieres ist hauptsächlich das Malz verantwortlich. Bei der Malzherstellung wird Getreide im Prozess des Mälzens zunächst so lange gewässert, bis es keimt. Im nächsten Schritt, dem Darren, wird das genau zum richtigen Zeitpunkt gewonnene Keimgut mittels Hitzezufuhr getrocknet und z.T. geröstet. Der Hitzegrad beim Darren
bestimmt die Farbe des gewonnenen Malzes und damit hauptsächlich auch die Bierfarbe. Ein Bier, das aus mit geringer Temperatur erhitztem Malz hergestellt wird, erhält eine relativ helle Bierfarbe. Wird das Bier entsprechend aus höher erhitztem Malz hergestellt, so nimmt es auch eine deutlich dunklere Bierfarbe an. Während die Bierfarbe beim Pils relativ hell ist, haben das Altbier und auch das Malzbier eine eher dunkle Bierfarbe. Sogar beim Weizenbier gibt es
Unterschiede bei der Bierfarbe, so dass hier zwischen hellem und dunklem Weizenbier unterschieden werden kann.
Biere mit besonders dunkler Bierfarbe wird extra noch Röstmalz (auch Farbmalz genannt) zugefügt. Dieses Malz wird
besonders heiss und lange gedarrt und wird dem Bier nur für die Bierfarbe zugefügt. Eine Röstmalz-Spezialität ist das
Schwarzbier, das sich durch eine besonders dunkle Bierfarbe von anderen Bieren abhebt.

Abb. 45. Bierfarben - ein offen-sichtliches und attraktives Merk-mal eines Bieres.

Abb. 46. Malz bringt Farbe ins Bier (Weyermann Malzschau-kasten) [Info]
Bildung von Farbstoffen.
Viele Farb- und Aromastoffe bilden sich mittels der sog. Maillard-Reaktion (Info). Bei Temperaturen über 90 °C und längerer Einwirkungszeit reagieren Aminosäuren zunehmend
mit Zuckern zu rotbraunen, aromaintensiven Verbindungen, den Melanoidinen (Info). Der
Umfang der Bildung der verschiedenen Verbindungen ist abhängig von der Temperatur, der
Dauer der Hitzeeinwirkung, dem pH-Wert sowie dem Feuchtegehalt des Grünmalzes während
des Darrens /--> Gefahr der Verkleisterung im Malzkorn und daraus die Bildung von nicht
mehr verwendungsfähigem Glasmalz (Info > Glasmalz). Diese thermische Belastung ist
messbar als "TBZ" (Thiobarbitursäurezahl): hohe TBZ-Werte --> hohe thermische Belastung -->
viele Farb- und Aromastoffe: bei dunklem Malz erwünscht; tiefe TBZ-Werte bei hellem Malz
erwünscht. Farbgebende Substanzen, die Melanoidine sind im Melanoidinmalz reichlich
vorhanden (rötliche Farbwirkung, 50-80 EBC), dafür aber infolge der Hitzeeinwirkung enzym-
ärmer und daher weniger verzuckernd wirkend (Kompensation mit z.B. Pilsener Malz).
Info: Maillard-Reaktionen: einfach erklärt chemische Vorgänge allg. Überblick Dissertation > mit Stichwort
"Maillard" suchen Bieralterung Beer color Beer color explained .
Neben Malzfarbe und Stammwürze hängt die Farbintensität des fertigen Bieres jedoch von
zahlreichen weiteren Faktoren ab wie beispielsweise der Zubereitung der Würze, der Hopfen-
gabe (Oxidation von Hopfenpolyphenolen --> Chinone als weitere färbende Verbindungen,
Eigenfärbung durch Hopfen, z.T. Gerbstoffe), allgemein Oxidationsreaktionen (Zufärbung, unerwünschte Geschmacksveränderungen/ Geschmacksfehler), dem pH-Wert und dem Gärungsprozess.
Abb. 48. Bestimmung der Bierfarbe.
Für den Heimbrauer kommen die Bierfarbkarte und
das iPad-App "Beer Judge" als einfache Verfahren in Frage.
Beeinflussung der Bierfarbe durch Malzmischungen
Gibt es eine Möglichkeit, die Farbe des Bieres im voraus zu beeinflussen oder gar zu bestimmen? Hanghofer
(Info, S. 77-78) schlägt folgendes Verfahren vor: "Um einen Durchschnitts- oder Richtwert zu erhalten, wie sich die Färbekraft des Malzes auf die Bierfarbe auswirkt, kann man die einzelnen Schüttungsanteile summieren:
Bierfarbe [EBC] = {Malz 1 [kg] x (Malzfarbe [EBC]) + Malz 2 [kg] x (Malzfarbe [EBC])
+ .... .... alle Anteile summieren}/Summe durch gesamtes Schüttungsgewicht [kg] dividieren
vgl. Abb. 38 betr. Malzfarbe, cf. auch Heimbrauer-Webshops, z.B. Sevibräu, Weyermann-Malze, Castle Malting
Die Farbe ist natürlich auch vom Extraktgehalt abhängig. Der nach obiger Formel erhaltene EBC-Wert kann
mit dem Konzentrationsfaktor Stammwürze [°P]/9 auf die gespindelte* Stammwürze korrigiert werden" (* bzw.
relative Dichte OG bestimmen, z.B. mit dem Tilt-Hydrometer oder dem EasyDens-Dichte- und Konzerntrations-
messgerät, dann auf Grad Plato umrechnen) "Bei hellen Bieren wird schliesslich noch die Zufärbung während
der Würzebereitung an Bedeutung gewinnen. Sie kann mit zwei bis vier EBC-Einheiten veranschlagt werden,
aber bei hoher Restalkalität des Brauwassers, Lufteintrag im Heissbereich und zu hoher thermischer Belastung
beim Würzekochen (Wasserverdampfung über 15%) auch wesentlich höher ausfallen."
Messtechnik
Brauindustrie: Die Farbe des Biers ist ein wichtiger Faktor bei der Beurteilung der Qualität. Gemäss den Vorschriften der EBC/MEBAK erfolgt die Messung der Farbe von Bier, Würze und flüssigen Malzersatzstoffen
spektralfotometrisch durch die Bestimmung der Absorption von durchgestrahltem Licht (= Transmissions-
verfahren) bei einer Wellenlänge von 430 nm und einer Schichtdicke von 1 cm, wobei als Einheit EBC (Farbe)
verwendet wird (Info).
Eine weitere neuere Methode ist die Erfassung des von Bier reflektierten Lichtanteils, ein Reflexionsverfahren
(Info).
Kleinbrauereien, Heimbrauer: Hier kommen eher visuelle Verfahren in Betracht, also Methoden, die auf der
Wahrnehmung der Farben vom menschlichen Auge basieren. Gerätetechnisch für Kleinbrauereien geeignet sind
augenbasierte oder spektralfotometrische Tintometer (Info 1, Info 2) oder handliche Pocket Kolorimeter (Info > PDF "Applikation: Bestimmung der Bierfarbe mit dem Pocket Colorimeter II (420 nm)).
Für den Heimbrauer geeignet sind die vereinfachten Verfahren mit einer standardisierten Bierfarbkarte (Info) und dazu geeigneten Gläsern (Info) und die "SRM Spectrum"-Funktion im iPad-App "Beer Judge (Info).
Detaillierte Anleitungen zur Farbstärke sind auf der Seite "Physikalisch-chemische Untersuchungen
im Braulabor" zu finden (siehe hier).
Hier geht es direkt zur PDF-Anleitung "Bierfarbe SRM/EBC: Welche Farbstärke hat das Bier?".
Abb. 47. Malz-Färbekraft.
Je nach Malzsorte bzw. Darren der Getreide- keimlinge ist die Färbekraft verschieden stark ausgeprägt [Quelle: Hanghofer, 2016, S. 78]
3. BRAUWASSER: Kernwissen für den Brauvorgang Versuch einer knappen Synthese
3.1. Gutes Brauwasser ist wichtig
Bier besteht aus über 90% Wasser und ist somit Hauptbestandteil des Bierkörpers. Die Qualität und Beschaffenheit ist von entscheidender Bedeutung für die Qualität des Bieres. Wasser ist trotzdem der von Heimbrauern am wenigsten beachtete Grundstoff des Bieres, obwohl
▸ Wassereigenschaften in der Maische entscheidend die Verzuckerung und Ausbeute beeinflussen
▸ je nach Bierstil eine charakteristische Ionenzusammensetzung prägend ist
▸ ungeeignetes Brauwasser sich negativ auf Aromen und Geschmack auswirken kann.
3.2. Herkunft des Wassers
Oberflächenwasser (z.B. aus Zürichsee, Bodensee), Grundwasser (z.B. Bad Ragaz Föhrenwald), destilliertes Wasser, Umkehr-Osmosewasser, filtriertes Wasser, Hahnenwasser.
In der Schweiz sind wir meistens in der glücklichen Lage, Quellwasser oder sicheres Trinkwasser ohne chemischen Zusätze (z.B. chloriertes Wasser) ab Wasserhahn zuhause zu beziehen. Quellwasser bzw. nicht aufbereitetes Trinkwasser ist immer die beste Wassergrundlage für Bier
3.3. Chemische Zusammensetzung des Brauwassers
3.3.1. Wasseranalyse
Wasserchemie ist nicht ganz einfach zu verstehen und nicht alle Bierbrauer haben Lust, sich in diese Materie einzuarbeiten.
Ausweg 1: Die lokale Trinkwasserversorgung muss den Konsumenten die Daten der chemisch/physikalischen Wasseranalysen jährlich einmal bekannt geben, meistens auf der entsprechenden Website der kommunalen Wasserversorgung oder auf Anfrage hin.
Ausweg 2: Die lokalen kleineren Wasserversorger untersuchen ihr Wasser meist nicht selbst, sondern lassen es in einem anerkannten professionellen Labor untersuchen, z.B. Schweiz: in den kantonalen Laboratorien (Bsp. Kanton Sankt Gallen: cf. hier). Private Personen können ebenfalls die Dienstleistungen solcher Labors gegen Bezahlung beanspruchen, oder aber auch bei anderen Anbietern (Bsp. hier).
Ausweg 3: Als Grundlage für Brauwasser dient destilliertes Wasser, meist als entionisiertes Wasser im Verkauf oder selbst hergestellt in einer Osmoseanlage (Umkehrosmose, z.B. siehe hier) oder mittels Mischbettvollentsalzer (Info). Dieses mineralien-/ionenfreie Wasser muss dann allerdings gemäss dem Bierstil durch Zugabe genauer Mengen definierter Salze und Säuren aufbereitet (“aufgesalzen”) werden.
3.3.2. Chemische Kenngrössen
Die wichtigsten im Brauwasser gelösten Ionen sind:
• Calcium (als Ca2+): natürlich vorkommendes Mineral, hauptverantwortlich für die
Wasserhärte. Erniedrigt pH-Wert der Maische, fördert Hefen-Ausflockung und damit
klareres Bier (geringere Trübung).
Günstig: 50 - 100 ppm.
• Magnesium (als Mg2+) ist ebenfalls Teil der Wasserhärte und erniedrigt den
Maische-pH-Wert. Wichtig für eine gute Hefeleistung.
Günstig: 10 bis 30 ppm.
• Chloride Cl- versüssen das Bier, verstärken Malzcharakter und Bierkörper.
Günstig: 0 - 150 ppm.
• Carbonate/Bicarbonat: CO32- und HCO3- bestimmen hauptsächlich die Alkalität
des Brauwassers und den Maische-pH-Wert.
Günstig: 25 - 50 ppm für helle Biere, 100 - 300 ppm für dunkle Biere.
• Natrium Na+: in richtiger Dosierung kann es einen malzig-vollen Bierkörper
unterstützen, zuviel Natrium verändert ungünstig den Geschmack des Bieres
(metallisch).
Günstig: 10 - 70 ppm.
• Sulfat SO4 2- verstärken den Hopfencharakter und erniedrigen den pH-Wert.
Günstig: 0 - 150 ppm.

Abb. 49. Brauwasser enthält gelöste Bestandteile, sog. Ionen, positiv oder negativ geladen.
Die "Aufbereitung" von Leitungswasser zu Brauwasser besteht in der Regel in der Anpassung des pH-Wertes sowie der Ionenkonzentrationen von Natrium, Calcium, Magnesium, Chlorid, Sulfat und Hydrogencarbonat an den gewünschten Bierstil. [Quelle: Braukurs]
3.3.3. Entscheidende Brauwasserparameter, die man bestimmen und berechnen muss
Säuregehalt (pH-Wert):
wird bestimmt durch den Anteil an H+-Ionen (präziser: H+ + H2O = H3O+ und OH–Ionen. Saure Lösungen haben einen Überschuss an H+, basische (alkalische) Lösungen einen OH–-Überschuss. Der pH-Wert der Maischelösung ist entscheidend für die optimale Wirkung der “Brauenzyme” wie Amylasen. Brauwasser sollte vorzugsweise nicht basisch sein, optimale pH-Werte > 7.0, z.B. 6.5.
Faustregel: Optimale Maische-pH-Werte liegen zwischen 5.2 bis 5.6.
Wasserhärte (Gesamthärte) ist vereinfacht ein Summenmass für den Ca- und Mg-Gehalt des Wassers. Sie setzt sich aus der für das Brauwasser wichtige Carbonathärte (= Cabonationen CO32- und Hydrogencarbonationen HCO3-, z.B. aus Kalk CaCO3 und Calciumbicarbo (Calciumhydrogencarbonat Ca(HCO3)2) und der “unwichtigen” Nichtcarbonathärte (z.B. Gips CaSO4). Die Carbonationen CO3 2- z.B. aus Kalk CaCO3 liegen im Wasser gelöst als Hydrogencarbonat-ionen HCO3- vor: sie fangen die "Säureteilchen" Wasserstoffionen H+ ab gemäss CO3 2- + H+ --> H2O + CO2 und verändern dadurch den pH-Wert nicht.
Faustregel: hartes Wasser ist eher vorteilhaft für Verringerung des Maische-pH-Wertes, Hefegesundheit, Gärfähigkeit und Klarheit des Bieres. Wichtiger Kennwert für das Brauwasser zur Bestimmung der Restalkalität.
Alkalinität (Alkalität): Die Alkalinität ist ein Mass für die Fähigkeit von Wasser, Säuren zu neutralisieren. Dies wird auch als Puffer- oder Säurebindungskapazität bezeichnet und beschreibt die Fähigkeit des Wassers, beim Hinzufügen von Säure einer Änderung des pH-Werts zu widerstehen.
Die Alkalinität wird vorwiegend wird durch folgende drei Alkali-Ionen im Wasser bestimmt: Hydrogencarbonat (HCO3-), Carbonat (CO3 2-) und Hydroxid (OH-).
Faustregel: Alkalinität ist eher ungünstig, weil sie den pH-Wert von Maische, Würze und Bier erhöht.
Restalkalität: Die Restalkalität ist eine Art Kenngrösse, die den pH-Wert mit der Wasserhärte verknüpft, die mit der Carbonathärte sowohl aciditätserhöhende als auch säurevernichtende Bestandteile, mit der Nichtcarbonathärte aciditätserhöhende und aciditätsneutrale Bestandteile
enthält. Die Restalkalität RA ist der Schlüsselparameter zur Bestimmung der Eignung eines Wassers als Brauwasser für einen bestimmten Bierstil und eine Art "Regler" zur optimalen pH-Wert-Einstellung der Maischereaktionen (pH 5.2 - 5.6).
FAZIT: ein absolutes Muss ist die Bestimmung des RA-Wertes des Wassers zur optimalen Bierstilwahl bzw. zur evtl. notwendigen Aufbereitung des Wassers zum geeigneten Brauwasser sowie die pH-Bestimmung und Einstellung des Maische-pH-Wertes zum optimalen enzymatischen Abbau/Verzuckerung der Stärke.
4. BRAUWASSER: Aufbereitungsverfahren
4.1. Raschaufbereitung von Wasser zum Brauwasser
▸ Chloride oder Chloramine entfernen:
nur bei desinfiziertem chloriertem Leitungswasser erforderlich, meist durch Kochen und/oder Zugabe von Kaliummetabisulfit (Kaliumdisulfit, Kalium-
yrosulfit, Campden, K2S2O5), 550 mg pro 20 L; cf. hier). Dieses Verfahren wird in der Schweiz mit der üblich hohen Trinkwasserqualität kaum benötigt.
▸ pH-Wert der Maische (nicht des eingesetzten Brauwassers!) bestimmen:
unmittelbar nach dem Einweichen des Malzschrotes pH-Wert rasch bestimmen und vorsichtig auf pH 5.2 bis 5.6 justieren:
Maische-pH > 5.6: pH-Wert senken durch Zugabe von Gips (Calciumsulfat Dihydrat Ca[SO4]·2H2O), Calciumchlorid CaCl2, Magnesiumsulfat
MgSO4 oder einer Säure (vorzugsweise Milchsäure C3H6O3, auch Phosphorsäure H3PO4).
Maische-pH < 5.2: pH-Wert erhöhen durch Zugabe von wenig Kalk (Calciumcarbonat CaCO3) oder reines Backpulver (Natriumbicarbonat, Natron, syn.
Natriumhydrogenkarbonat NaHCO3; Bezug z.B. hier oder Drogerien und Reformhäuser).
▸ Geeignete Wasserprofile für spezifische Bierstile auswählen (cf. brau!magazin hier > Kap. 2.2. Zielwerte nach Bierstil): z.B.
- Helles Lagerbier: RA -3-0 °dH, Ca [mg/L] 30-50, Mg [mg/L] 0-20, Sulfat [mg/L] 0-50, Chlorid [mg/L] 50-100, Aufbereitung: Entkarbonisierung,
Maischesäuerung auf pH 5.4.
- Böhmisches Pilsener-Bier: -2-0°dH/ 0-30/ 0-20/0-50/ 0-50/ Vollentsalzung, Maischesäuerung auf pH 5.4.
- Witbier, Kölsch: -3-0 °dH/ 50-100/ 0-25/0-50/ 0-100/ Entkarbonisierung, Maischesäuerung auf pH 5.4.
4.2. Fazit: Optimales Vorgehen zur Aufbereitung von Leitungswasser zu Brauwasser für einen bestimmten Bierstil
1. Wasserkenngrössen des Trinkwassers beschaffen (kommunale Wasserversorgung), vergleichend bewerten, Restalkalität berechnen
2. Bierstilkenndaten (Wasserprofil) beschaffen und Aufbereitung planen (d.h. entsprechende Brausalze vorrätig halten)
3. Aufbereitung Trinkwasser zum gewünschten Brauwasser: Berechnungen
notwendige Salzzugaben mit einem Braurechner berechnen lassen (Braurechner: cf. hier > Weitere Informationen: Auswahl treffen, z.B. BräuReKa-!
Müggelland Brauerei, Maischemalzundmehr, Brewfather (Info), Fabier, Brewer’s Friend, BFWater Calculator u.a.
4. Aufbereitung Trinkwasser zum gewünschten Brauwasser: Vorbereitung
Je nach vorliegender Trinkwasserzusammensetzung kann das Brauwasser direkt aufbereitet werden durch Zugabe der berechneten Brausalzmengen,
oder aber durch Vollentsalzung (2 Verfahren, cf. 2.1. Wasseranalyse, Ausweg 3) oder Verschnitt (= Verdünnung) durch Vermischung mit zugekauftem
entionisiertem Wasser: je nach Mischverhältnis erfolgt eine entsprechende Verdünnung der Ionenkonzentrationen.
5. Aufbereitung Trinkwasser zum gewünschten Brauwasser: Aufbereitung durch Aufsalzung
Genaues Abwägen und Zugabe der Brausalze.
6. Maischekontrolle: ca. 10 min nach Beginn der Einmaischung pH-Wert bei 25 °C bestimmen und evtl. entsprechend korrigieren (z.B. Zugabe von
Milchsäure, oder cf. Pkt. 3 Raschaufbereitung).
5. BRAUWASSER: Informationen
5.1. Wasserrechner
Bru'n Water: Water knowledge (ausführliche Abhandlung über Grundlagen der Wasserchemie) Bru'n Water Homepage Bru'n Water Program .
Brewer's Friend: Brewing Water Chemistry Calculator Info
Brewer's Friend: Mash Chemistry and Brewing Water Calculator Info
EZWater Calculator Info
Glenn Tinseth: Water chemistry calculator Info
Brautool (engl., kostenpflichtig, Wasserberechnungen integriert): BeerSmith
Brautool (engl., kostenpflichtig, Wasserberechnungen integriert): Brewfather
5.2. Literatur
Hagen, R., Heimbrauen für Fortgeschrittene. Verlag Hans Carl, Nürnberg. 128 S., 5. Aufl. (2021).
Palmer, J., Kaminski, C., Water. A comprehensive guide for brewers. Brewers Publications, Boulder CO, USA. 296 S., 1. Aufl. (2013). Info
Palmer, J.J., Erfolgreich Bier brauen. Ein Ratgeber für Anfänger und Fortgeschrittene. Mobiwell Verlag, Immenstadt. 721 S., 1. Aufl. (2019)
5.3. Internet-Artikel
Flowers Jeff: Comparing Different Types of Water for Homebrewing Info
Mayknecht Tobias (Malzknecht): Brauwasser in 6 Minuten erklärt Brauwasserrechner (Brewfather, EZ Water Calculator)
Öfele Martin. Das Brauwasser: Anforderungen & Wasserhärte Info
Palmer John: Using Salts for Brewing Water Adjustments Info
Schröder Fabian: Brauwasser: Einfache Wasseraufbereitung mit Milchsäure Info
Sedam Marc: A Guide to Brewing Water Treatment Info
Terrill Sean: Basic Water Chemistry for Brewing Info
Winning Homebrew: Brewing Water Analysis and Treatment Info
5.4. Instruktions-Videos
John Palmer: Residual Alkalinity & Brewing Water Info
Imperial Yeast: Basic Water Chemistry: Brewing Salts Info
Bobby M: Brew Water Chemistry - Part 1 Info
Bobby M: Brew Water Chemistry - Part 2 Info
David Heath Homebrew: Homebrew Water Treatment - Easy Guide Info (einfachste Erklärung).
.
MUG
Mikrobrauerei
seit 2012
Für Edge+Chrome+Firefox auf Notebook, Personal Computer und iPad optimiert, für Smartphones ungeeignet
06.02.2026